이중항체 '토베시미그', 담도암 사망률 예상보다 낮아
아이맵, '지바스토믹', 임상1b 상 환자 조기 모집
에이비엘바이오, BBB셔틀 외 이중항체 등 파이프라인 다각화 전략 박차

에이비엘바이오가 개발한 이중항체 신약 후보물질들이 잇달아 글로벌 임상에서 성과를 내며 업계의 시선을 끌고 있다. 이중항체 '토베시미그'는 담도암 2차 치료제 승인 가능성을, '지바스토믹'은 적응증 확장 가능성을 한층 구체화했다.
에이비엘바이오(대표 이상훈)의 파트너사 컴퍼스테라퓨틱스(나스닥 CMPX)와 아이맵테라퓨틱스(나스닥 IMAB)는 각각 토베시미그와 지바스토믹의 최신 임상 진행 상황을 11일(미국 현지시각) 발표했다. 업계에서는 두 파이프라인 모두 내년 상반에 핵심 데이터가 공개될 것으로 보고 있으며, 결과에 따라 에이비엘바이오의 상업화 전략이 본격적인 속도를 낼 것으로 전망하고 있다.
담도암 2차 치료제 '토베시미그'…낮은 사망률 확인
에이비엘바이오가 개발해 컴퍼스테라퓨틱스에 기술이전한 Grabody-T 기반 이중항체 '토베시미그(ABL001, VEGF-A x DLL4)'는 진행성 담도암 2/3상에서 전체생존기간(OS)의 연장 가능성이 확인됐다.
컴퍼스테라퓨틱스는 임상 2/3상(COMPANION-002) 중간 분석에서 OS 연장 가능성을 시사하는 결과를 발표했다. 예상보다 사망자 수가 적어 최종 분석 시점이 내년 1분기로 연기됐다는 설명이다.
이 임상은 진행성 담도암 환자를 대상으로, 2차 치료에서 토베시미그ㆍ파클리탁셀 병용군과 파클리탁셀 단독군을 비교하는 무작위배정 시험이다.
지난 4월 공개된 톱라인 결과에서 토베시미그 병용군의 객관적 반응률(ORR)은 17.1%로, 파클리탁셀 단독군의 5.3% 대비 3배 이상 높았다(p=0.031). 완전관해(CR) 사례도 1건 보고됐다. 2차 평가변수인 전체생존기간(OS)과 무진행생존기간(PFS) 분석은 사망 누적 비율이 80%에 도달했을 때 실시하도록 설계됐으나, 현 시점에서 목표 사건 수에 도달하지 않아 분석 시점이 내년 1분기로 연기됐다. 회사는 이 결과가 토베시미그가 환자 생존기간에 긍정적 영향을 줄 가능성을 시사할 수 있다고 설명했다.
토베시미그는 종양 혈관 형성의 두 핵심 경로인 VEGF-A와 DLL4–Notch를 동시에 차단하는 이중특이항체다. VEGF-A는 혈관 성장 속도를 높이고 DLL4–Notch는 무분별한 성장을 제어하는데, 두 경로를 동시에 차단해 보상 활성화를 억제함으로써 항종양 효과를 극대화하는 전략이다. 특히 투여 초기에는 '혈관 정상화' 구간이 나타나 약물 전달 효율이 높아지는데, 이 시점에 파클리탁셀을 병용해 초기 반응과 지속 효과를 동시에 노린다.
앞서 한국에서 진행된 2상 병용 투여 결과는 글로벌 임상에 대한 기대를 한층 높였다. 전체 환자 ORR은 37.5%, 2차 치료군은 63.6%, 3차 치료군은 15%를 기록했으며, 무진행생존기간 중앙값은 9.4개월, 1년 생존율은 53%였다. 이는 표준치료인 ABC-06(FOLFOX)의 OS 중앙값 6.2개월, 18개월 생존율 10% 미만 대비 개선된 성과다.
최종 OS·PFS 분석 결과는 내년 1분기 발표가 예상되며, 컴퍼스테라퓨틱스는 심층 논의를 거쳐 같은 해 중반 생물의약품허가신청(BLA) 제출을 목표로 한다. 아울러 DLL4 발현이 높은 위암, 난소암, 간암 등을 대상으로 한 바스켓 임상도 추진할 계획이다.
위암 1차 치료제 '지바스토믹'…조기 모집으로 속도전
담도암에서 진전에 이어 위암 치료제 개발도 탄력을 받고 있다. 에이비엘바이오가 아이맵과 공동 개발 중인 4-1BB 기반 이중항체 '지바스토믹(ABL111, Claudin18.2 x 4-1BB)'은 위암 1b상에서 환자 조기 모집을 마치며 개발 속도를 높였다.
아이맵은 병용요법 임상 1b상 용량 확장 파트 환자 모집이 당초 계획보다 앞당겨 완료됐다고 11일(현지 시각) 밝혔다. 이번 단계에서는 선행 시험에서 안전성이 확인된 8mg/kg과 12mg/kg 두 용량군에 대해 환자 수를 확대해 효과와 내약성을 검증하며, 총 40명이 등록됐다.
지바스토믹 역시 에이비엘바이오의 '그랩바디-T' 플랫폼을 적용한 면역항암제로, 클라우딘18.2 발현 종양 부위에서만 4-1BB를 활성화해 T세포 증식과 세포독성을 높이되 정상 조직 손상은 최소화하는 기전을 가진다.
현재 PD-1 억제제인 옵디보(성분 니볼루맙)과 표준 화학요법 mFOLFOX6를 병용해, 클라우딘18.2 양성 위암 환자의 1차 치료 효과를 평가 중이다. 화학요법은 종양 세포를 사멸시키며 항원 방출과 면역 억제 세포 감소를 유도해 면역 활성 환경을 조성한다. 이후 지바스토믹이 4-1BB를 활성화해 T세포 반응을 강화하고, 니볼루맙이 PD-1을 차단해 이를 지속시키는 것이 병용 전략의 핵심이다.
키움증권 리서치센터는 지바스토믹이 아스텔라스의 위암 치료제 빌로이(성분 졸베툭시맙)와 비교해 안전성과 효능 측면에서 경쟁 우위를 점할 가능성이 높다고 분석했다.
키움증권 보고서에 따르면 졸베툭시맙은 표적 단백질인 클라우딘18.2의 발현 비율이 75% 이상인 환자만을 대상으로 승인돼 전체 환자군 중 고발현 집단에 국한된다. 반면 지바스토믹은 CLDN18.2 발현율이 1%에서 100%까지의 환자군을 모두 치료 대상으로 포함할 수 있도록 설계돼, 저발현 환자군까지 포괄함으로써 실제 치료 대상 인구와 시장 규모를 기존 대비 약 두 배로 확장할 수 있다는 설명이다.
또한 효능 측면에서도 긍정적인 초기 임상 데이터를 확보했다. 선행 임상에서 유효 용량군(8mg/kg, 12mg/kg) 환자 12명 중 10명이 종양 크기 감소를 보여 객관적 반응률(ORR) 83%를 기록했다. 키움증권은 이 결과가 고발현 환자에 국한된 경쟁 약물 대비 더 넓은 환자군에서 높은 반응률을 기대할 수 있음을 시사하며, 향후 글로벌 기술이전 및 상용화 협상에서도 강력한 차별화 포인트로 작용할 수 있다는 평가다.
플랫폼 확장과 파이프라인 다변화…사업 가속화 전망
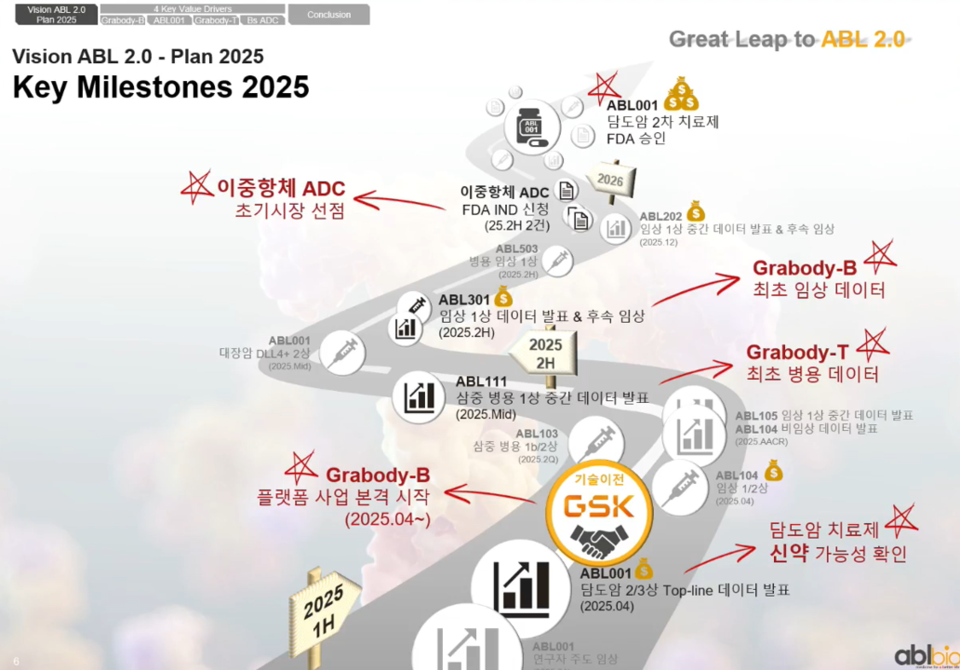
에이비엘바이오는 그랩바디-T 외에도 BBB 셔틀 플랫폼 '그랩바디-B', ADC, 다중표적 이중항체 등 포트폴리오를 보유하고 있다. 그랩바디-B는 사노피와 GSK에 기술이전된 바 있으며, 회사는 알츠하이머병 등 퇴행성 뇌질환 치료뿐 아니라 siRNA 기반 근육 약물 전달, 비만 치료제 확장 가능성도 모색 중이다.
항암제 파이프라인에는 토베시미그, 지바스토믹 외에도 ROR1 ADC(ABL202), α-시누클레인 타깃(ABL301), PD-L1 x 4-1BB(ABL503), HER2 x 4-1BB(ABL105), B7-H4 x 4-1BB(ABL103), EGFR x 4-1BB(ABL104) 등 다수의 임상이 미국, 중국, 호주, 한국 등에서 진행되고 있다.
에이비엘바이오 관계자는 "담도암 2차 치료제 신약 가능성을 확인할 수 있는 ABL001의 생존 기간 데이터는 현재 환자들이 예상보다 오래 생존하고 있어 고무적"이라며 "아울러 ABL111 병용요법 개발이 가속화되고 있는 만큼, 다른 4-1BB 기반 이중항체의 병용 임상도 조속히 추진하겠다"고 말했다.
관련기사
- 컴퍼스 테라퓨틱스 "토베시미그, 담도암 사망률 낮아"
- 에이비엘바이오-아이맵, ABL111 병용요법 임상 1b상 용량 확장 파트 환자 모집 '끝'
- 에이비엘바이오, 이중항체 ABL503 미국·캐나다 특허 결정
- 이상훈 대표 "ABL111 글로벌 블록버스터 자신…Grabody-B로 사업 본격"
- 에이비엘바이오, AAIC 2025서 BBB 셔틀 '그랩바디-B' 비임상 데이터 공개
- ABL Bio Pushes Ahead in Cancer Trials, Eyes 2026 Breakthrough
- 에이비엘바이오 "BBB 통과해 파킨슨병 원인 'α-synuclein' 잡았다"
- 리가켐·ABL·오름·인투셀, 중국 강세 속에서도 빛날 'ADC 국가대표'
- 에이비엘바이오, 파킨슨병 치료 ABL301 미국 1상 결과 발표
- BBB 첫 관문 넘은 에이비엘바이오... "후속 빅딜 기대"
- 에이비엘바이오 "내년 1분기 ABL111 병용1b상 탑라인 데이터 발표"

