삼성바이오에피스, 아일리아 바이오시밀러 '아펠리부주' 허가
AZ, EGFR 변이 폐암 대상 타그리소 단일군과 Dato-DXd 병용군 비교
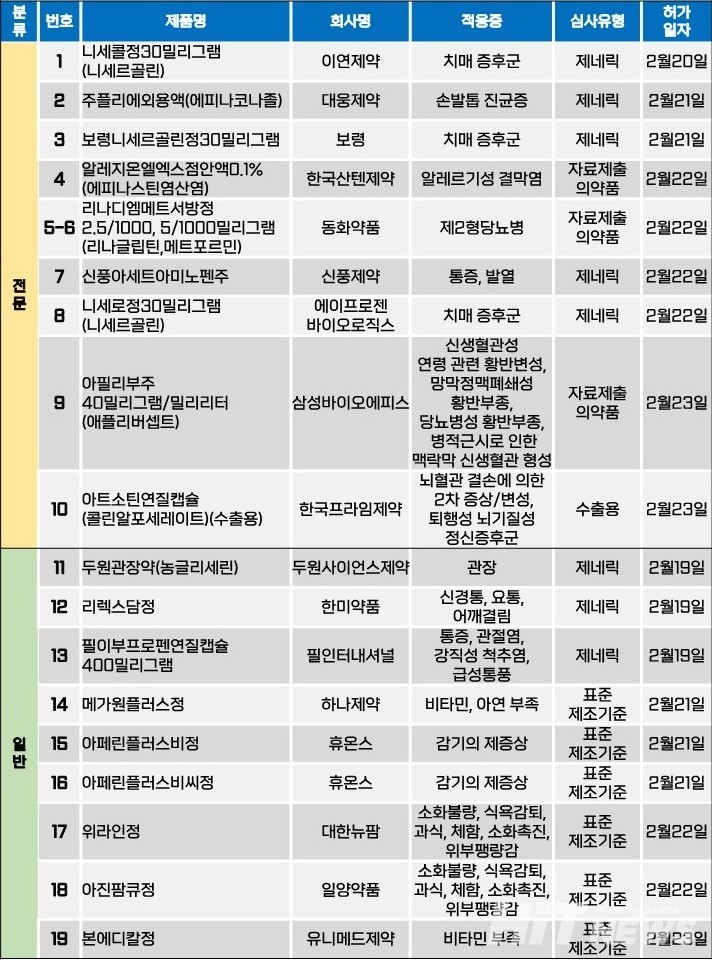
지난주(2월 19~23일) 총 19개 품목이 식품의약품안전처로부터 품목허가를 받았다. 전문의약품이 10개 품목, 일반의약품은 9개 품목이었다. 이 의약품들은 제2형 당뇨병, 치매증후군, 손발톱 진균증, 알레르기성 결막염, 신생혈관성 연령 관련 황반변성 등 다양한 적응증으로 허가됐다.
삼성바이오에피스가 개발한 신생혈관성 연령 관련 황반변성 등 안과질환 치료제인 '아필리부주(성분 애플리버셉트)'가 지난 23일 허가됐다. 아필리부주는 미국 제약바이오기업인 리제네론과 바이엘이 공동 개발한 '아일리아'의 바이오시밀러다.
아일리아는 항-혈관내피세포성장인자(anti-VEGF) 제제다. 신생혈관성 연령 관련 황반변성의 치료(nAMD), 망막정맥폐쇄성 황반부종에 의한 시력 손상의 치료, 당뇨병성 황반부종에 의한 시력 손상의 치료, 병적 근시로 인한 맥락막 신생혈관 형성에 따른 시력 손상의 치료 등에 사용되고 있다.
삼성바이오에피스는 지난 2020년 6월부터 2022년 3월 총 10개국 449명의 nAMD 환자를 대상으로 아일리아와 아필리부의 안전성 및 유효성, 약동학적 특성과 면역원성을 비교한 글로벌 3상 임상시험을 진행해 동등성을 입증했다. 작년 4월에는 미국 시력안과학회(ARVO) 연례 학술대회에서 임상 3상 최종 데이터를 공개했으며, 이를 통해 오리지널의약품과의 유효성 및 안전성 등의 임상의학적 동등성을 확인한 바 있다.
이번 허가로 삼성바이오에피스는 국내 첫 아일리아 바이오시밀러를 보유하게 됐다. 현재 국내에서 아일리아 바이오시밀러 허가 심사를 진행 중인 업체로는 셀트리온, 삼천당제약 등이 있다.
한편, 삼성바이오에피스는 지난 2022년 안과질환 치료제인 '루센티스' 바이오시밀러인 '아멜리부(성분 라니비주맙)'를 허가받은 바 있다. 회사가 보유한 허가 바이오시밀러의 제품 수는 아일리아를 포함해 총 8개로 늘어나게 됐다.
아필리부와 아멜리부의 국내 판매는 삼일제약이 맡는다. 두 회사는 2022년 6월 아멜리부에 대한, 또 올해 2월에는 아필리부에 대한 마케팅 파트너십 계약을 체결한 바 있다.
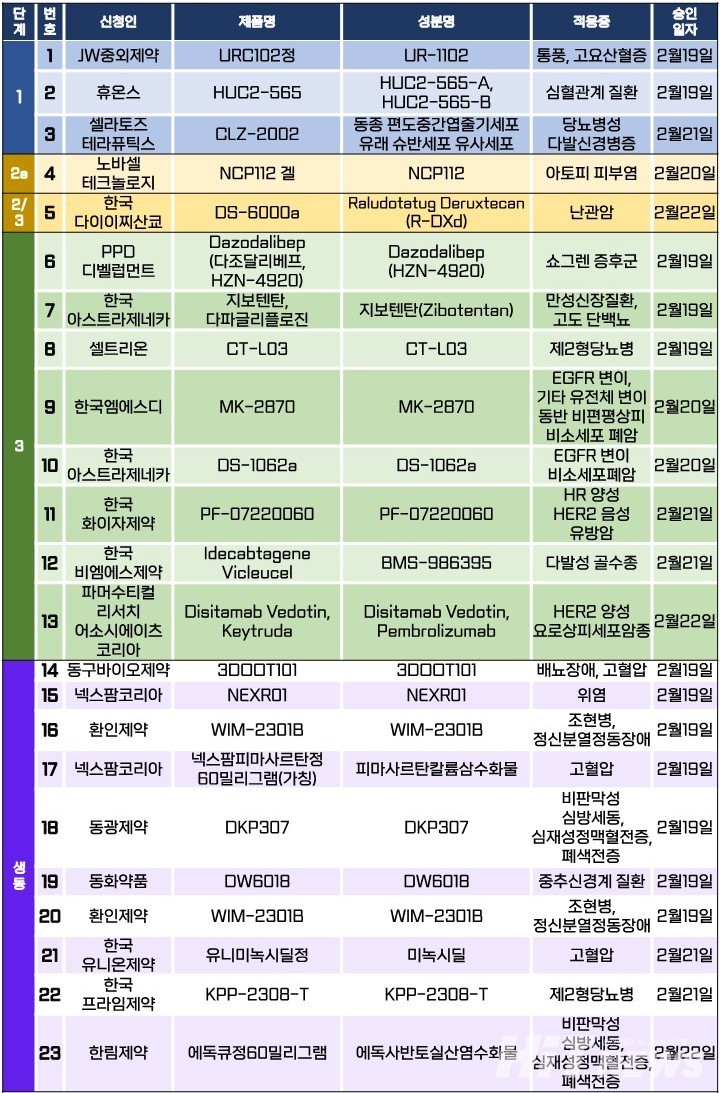
지난주 임상시험계획은 총 23건이 승인됐다. 세부적으로 △1상 3건 △2a상 1건 △2/3상 1건 △3상 8건 △생물학적 동등성 10건 등이다. 이 임상시험들은 통풍, 당뇨병성 다발신경병증, 아토피 피부염, 쇼그렌 증후군, 만성신장질환, 제2형 당뇨병 등 질환과 난관암, 비소세포폐암, 유방암, 요로상피세포암, 다발성 골수종 등 암종을 대상으로 승인됐다.
아스트라제네카는 자사 3세대 TKI 치료제 '타그리소(성분 오시머티닙)'와 현재 개발 중인 항체약물접합체(ADC) '다토포타맙 데룩스테칸(Datopotamab deruxtecanㆍ이하 Dato-DXd)'의 병용요법을 확인하기 위한 3상 임상시험계획을 지난 20일 승인받았다.
Dato-DXd는 아스트라제네카와 다이이찌산쿄가 공동 개발중인 ADC로, 'TROP2 단백질'을 타깃한다. 최근 미국 식품의약국(FDA)으로부터 전신 치료를 받은 적이 있는 국소 진행성 또는 전이성 비편평 비소세포폐암(NSCLC) 치료제로서 바이오의약품 품목허가 신청(BLA)이 승인된 바 있다.
이번에 진행되는 임상시험(연구명 TROPION Lung14)은 'EGFR 변이 양성인 국소 진행성 또는 전이성 비소세포폐암(NSCLC) 환자'의 1차 치료제로서 'Dato-DXd+타그리소' 병용요법과 '타그리소' 단일요법을 평가하기 위한 공개 라벨, 무작위 배정 3상 연구다. 연구진은 35명(글로벌 572명)의 환자를 대상으로, 오는 10월부터 2025년 11월까지 △서울대병원 △연세대 세브란스병원 △삼성서울병원 등 의료기관에서 임상시험을 진행하는 것을 목표로 설정했다.
임상시험계획서에 따르면, 연구진은 이번 연구의 1차 평가 목적을 위해 △이상반응(CTCAE v5에 따라 등급을 매김) △임상화학 △혈액학 △뇨분석 △활력징후 △신체검사 △체중 △좌심실박출률(LVEF) △심전도(ECG) 파라미터 등을 WHO 활동도 상태의 측면에서 평가한다.
또 2차 유효성 평가변수로 독립적 중앙 맹검 평가(BICR)에 의한 △객관적 반응률(ORR) △반응 기간(DoR) △오시머티닙과 그 대사체(AZ5104), Dato-DXd, 총 항-TROP2 항체, DXd의 혈장 농도 △Dato-DXd에 대한 ADA의 유무(확증적 분석 결과: 양성/음성, 역가, 중화항체) 등으로 설정했다.
한편, 타그리소와 경쟁약인 유한양행의 '렉라자(성분 레이저티닙)'는 지난 1월부터 '유전자 검사에서 비소세포폐암 관련 유전자 변이(EGFR 엑손19 결손 또는 엑손 21(L858R) 치환 변이)가 있는 국소 진행성 또는 전이성 비소세포폐암 1차 치료'를 목적으로 급여기준이 확대돼 사용되고 있다.
관련기사
- 삼성바이오에피스, 아일리아 바이오시밀러 '아필리부' 국내 허가받아
- 고용량 '아일리아' 상업화 맞서 국내사 "저용량 바이오시밀러 먼저"
- 유사 적응증 '아일리아·루센티스' 시밀러 확보한 삼일제약 묘수 있나
- 삼일제약, 삼성바이오에피스와 '아일리아' 시밀러 국내 마케팅 계약
- 오늘 특허 만료 '아일리아'… '국내사 시밀러' 줄줄이 출격 준비
- "세계 폐암 환자 절반 치료" AZ, 큰 그림 완성 위한 본격 행보
- AZ·다이이찌산쿄, 제2의 엔허투 '다토포타맙' 시동걸었다
- 아스트라제네카, 'Dato-DXd' 병용 임상 종횡무진…ADC 시너지 노려
- 여성 암 사망 1위가 폐암? "통증 느끼면 이미 늦어 조기 진단 중요"

