10월 신약(NDA) 10건, 생물의약품(BLA) 2건 등 12건 승인
다발골수종 치료제 '블렌렙', 갱년기 안명홍조 치료제 '린퀴에트' 등
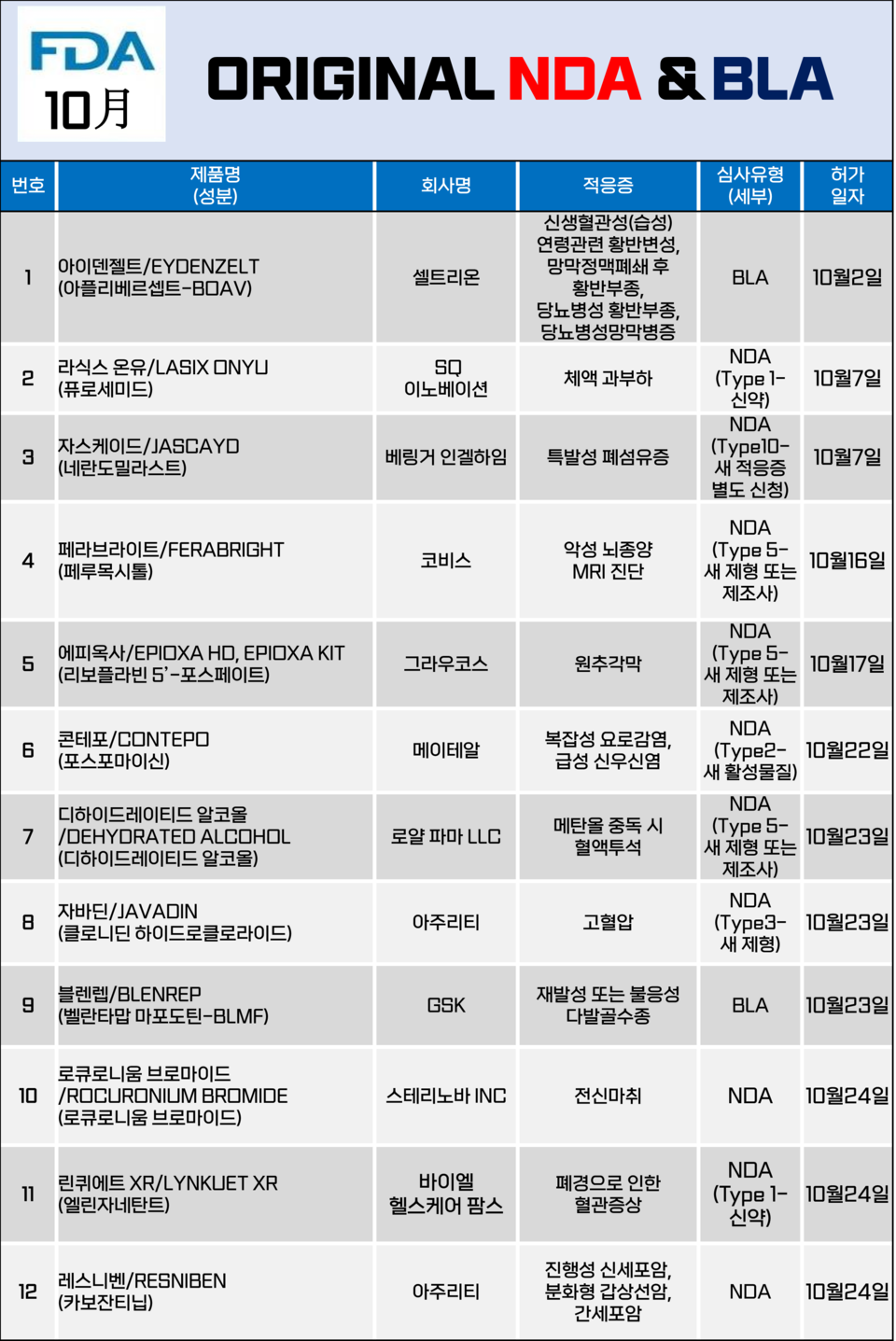
미국 식품의약국(FDA)은 10월 12개 제품을 신약 또는 개량신약으로 허가했다. 주로 저분자의약품을 대상으로 하는 신약 허가 신청(New Drug application·NDA)은 10건, 생물의약품 허가 신청(Biologics Licensing Applications·BLA)은 2건이 승인됐다.
대상 적응증은 황반변성, 특발성 폐섬유증, 고혈압, 다발골수종 및 신세포암 등이었다.
10년만 새로운 특발성 폐섬유증 '자스케이드'

10년만에 미국 시장에 새로운 특발성 폐섬유증 옵션이 등장했다.
베링거인겔하임은 10월 7일 FDA에서 성인 특발성 폐섬유증 환자를 위한 경구용 치료제 '자스케이드(성분 네란도밀라스트)'를 허가받았다.
특발성 폐섬유증은 원인을 알 수 없는 이유로 폐 조직이 점점 섬유화돼 그 기능을 상실하는 질환이다. 이 질환 환자들은 진단 후 5년 내 절반에 가까운 환자가 사망하는 것으로 알려졌으며, 그 비율은 전립선암, 유방암, 대장암 등 암종에 비해 낮다.
이번에 허가된 네란도밀라스트는 PDE4B(phosphodiesterase 4B) 를 선택적으로 억제하는 치료제로, 항섬유화 및 면역조절 작용을 통해 특발성 폐질환 환자의 폐 기능 저하 속도를 늦춘다.
베링거인겔하임은 이 치료제를 FDA에서 우선심사 및 혁신치료제 지정 절차를 통해 승인받았다.
품목 허가는 유의미한 폐 기능 감소 억제 효과를 확인한 ‘FIBRONEER-IPF’ 연구와 2상 임상 결과를 근거로 이뤄졌다. 이 연구에서 네란도밀라스트 투여군은 52주차 기준 18㎎ 투여군에서는 106㎖, 9㎎ 투여군에서 122㎖로 위약군 170㎖ 대비 유의미한 강제폐활량(FVC) 변화를 보였다.
더불어 투약 2주차부터 효과가 나타나기 시작했으며, 52주까지 점차 그 격차를 벌어진 것으로 나타났다. 가장 흔한 이상반응은 설사(18㎎ 투여군 : 42%, 9㎎ 투여군 31%)였다.
'샤샹크 데슈판데(Shashank Deshpande)' 베링거인겔하임 이사회 대표/인체의약부 총괄은 "특발성 폐섬유증 환자들의 치료 옵션은 10년이 넘게 정체돼 왔다. 이번 허가로 치료 환경이 변화하기 시작했다"고 밝혔다.
회사는 현재 중국, 일본, 유럽(EU) 등에서 품목허가를 진행 중이며, 그 외 지역으로 점차 확대한다는 방침이다.
재발/불응성 다발골수종 사망 위험 51% 감소 '블렌렙'

글락소스미스클라인(GSK)는 지난 10월 23일 미국 FDA에서 자사 블렌렙(성분 벨란타맙 마포도틴)과 보르테조밉+덱사메타손 병용요법(BVd 요법)을 프로테아좀 억제제(PI) 및 면역조절제 포함 최소 2차 이상 치료를 받은 재발/불응성 다발골수종 성인 환자를 대상으로 허가받았다.
다발골수종은 전세계에서 3번째로 흔한 혈액암으로 꼽힌다. 면역과 관련된 형질세포가 비정상적으로 증식돼 발생하는데, 완치율이 낮고 대다수의 환자가 1차 치료 후 일정 시점에 재발을 경험한다. 이에 완치보다는 장기 관리가 치료에 핵심으로 꼽힌다.
블렌렙은 항-BCMA 단일클론항체에 독성 약물 아우리스타틴 F를 비가수분해성 링커로 연결한 항체-약물접합체(ADC)로, 씨젠(Seagen)의 비분해성 링커 기술과 쿄와기린그룹 'BioWa'의 'POTELLIGENT' 기술이 더해져 개발됐다.
허가 근거가 된 3상 'DREAMM-7' 연구 결과, 프로테아좀 억제제 및 면역조절제 등 치료 경험이 있는 3차 이상 환자군에서 블렌렙 병용군은 다라투무맙+보르테조밉+덱사메타손 3제 요법군 대비 사망 위험을 51% 감소시킨 것으로 나타났다. 더불어 무진행생존기간은 블렌렙군 31.3개월, 다라투무맙군 10.4개월로 약 3배 이상 길었다.
GSK는 지난 7월 23일 미국 식품의약국(FDA) 항암제자문위원회(ODAC)에서 ‘수용 불가’ 판정을 받으면서, 허가에 난항을 겪었다. 당시 위원회는 흐릿한 시야, 광과민증, 안구 건조 등 시각계 이상반응과 용량 조절 방식 그리고 미국 환자 데이터가 적은 점을 지적했다. 다만, 이번 FDA의 최종 허가로 환자들에게 사용될 수 있게 됐다.
토니 우드(Tony Wood) GSK 최고과학책임자는 "다발골수종 환자는 대부분 재발을 경험하고, 동일 기전의 약물을 재사용할 경우 예후가 좋지 않았다"며 "블렌렙은 상급 병원이 아닌 지역사회 내 의료현장에서도 투여할 수 있는 항-BCMA 약물로, 환자들의 치료 접근성을 크게 높일 것으로 생각한다"고 밝혔다.
회사는 해당 임상 데이터를 올해 NCCN 가이드라인에 제출해 등재를 추진하며, 중국 허가 신청도 계획중인 것으로 나타났다. 현재 EU, 영국, 일본, 캐나다, 스위스, 브라질 등에서는 2차 이상 치료제로 허가된 상태다.
바이엘, 비호르몬 성분 갱년기 안면홍조 치료제 '린퀴에트' 허가

바이엘 헬스케어는 지난 10월 24일 폐경 관련 중등도~중증 안면홍조를 치료제 '린퀴에트(성분 엘린자네탄트)'를 허가받았다.
기존 갱년기 안명홍조 치료제가 에스트로겐, 프로게스테론 등 여성호르몬 성분을 포함해 왔다. 이와 달리 린퀴에트는 NK1, NK3를 타깃하는 이중 수용체로 허가된 첫 신약으로, 1일 1회 취침 전 경구 복용하면 된다.
NK1과 NK3을 조절해 체내 신호전달 물질인 서브스탄스 P(Substance P) 및 뉴로키닌 B(Neurokinin B) 신호전달을 억제함으로써, 안명홍조와 관련된 체온조절 신경회로(KNDy 뉴런)의 활동을 조절한다.
임상은 3상 임상인 'OASIS 1', 'OASIS 2', 'OASIS 3' 등 3건의 연구를 바탕으로 이뤄졌다. 각 임상에서 린퀴에트 복용군은 유의미한 안면홍조 빈도, 중증도 감소를 보였고, 52주 복용을 통한 장기 안전성도 입증했다.
다만, 중추신경계 영향, 간효소 상승, 유산 위험, 발작 위험 등이 보고돼 임신 중에는 복용이 금지된다. 이 외에 두통, 피로, 어지러움, 졸림, 복통, 발진 설사, 근육경련 등이 흔한 이상반응(5% 이상 빈도)으로 나타났다.
바이엘 측은 현재 호주, 캐나다, 영국, 스위스 등에서 린퀴에트를 출시한 상황이며, 이달 중 미국 시장 내에서도 시행할 방침이다. 더불어 유럽 EMA에 허가 심사를 진행중에 있는 것으로 나타났다.
관련기사
- 베링거인겔하임, 존거티닙·네란도밀라스트 등 주력품 출시 박차
- 베링거, 진행성 폐섬유증 치료제 '네란도밀라스트' 3상 톱라인 "긍정"
- GSK, 블렌렙 FDA 심사 일정 연기… 새 PDUFA 결정일 10월 23일
- GSK '블렌렙' FDA 자문위서 부정적 평가…재승인 '빨간불'
- GSK '블렌렙', 고도 시력 저하·각막 독성으로 FDA 검토 난항
- GSK 블렌렙, 재발·불응성 다발골수종 1차 재발 치료제 '권고'
- 오페브 제네릭 공세 속 IPF 후발약 '자스케이드' 도입으로 반격
- 글로벌 빅파마, '두 번째 렉라자' 찾는다… 투자 넘어 공동 성장으로

