특별기고 |
배진건 배진 바이오사이언스 대표

2024년 12월 23일 기준으로 대한민국 65세 이상 노인 인구는 1024만4550명으로 전체 주민등록 인구의 20%를 차지하며 초고령 사회에 진입했다. 성별로 보면 남자 454만6287명(17.83%), 여자 569만8263명(22.15%)으로 여성 노인 인구 비율이 더 높다. 아무래도 여성이 오래 살기에 65세 이상 노인의 56%가 여성이고 44%가 남성이다.
초고령 노인이 많이 앓는 알츠하이머병(AD) 독특하게 여성 노인의 병이다. 자료를 다시보면 2021년 대한민국 알츠하이머병 진료 환자 59만 3270명 중 71.4%인 42만 4117명이 여자이다. 2017년(72.1%)과 비슷한 것을 보면 알츠하이머 치매 여자/남자 비가 바로 7대 3이다.
미국의 경우도 2025년 알츠하이머병 환자가 700만명을 넘은 것으로 추정하고 있다. 미국도 한국과 마찬가지로 알츠하이머병의 3분의 2가 여성이다. 과학자들이 어떻게 알츠하이머병이 왜 여성에게 더 많은 지 정확하게 알지 못한다.
2021년 12월 6일 자의 국제학술지 <네이처 에이징>에 클리블랜드 클리닉의 페이슝 쳉(Faxiong Cheng) 박사 연구팀이 논문 한 편을 발표했다[Nat Aging. 2021 Dec;1(12):1175-1188. doi: 10.1038/s43587-021-00138-z. Epub 2021 Dec 6.].
연구팀은 네트워크 기반 분석을 통해 미국 식품의약국(FDA)에서 허가받은 1609개의 의약품 가운데 아밀로이드와 타우 기전에 ‘비아그라’라는 상품명으로 더 유명한 발기부전 치료제 실데나필(sildenafil)’이 알츠하이머 치료제를 위한 약물재창출망에 가장 높은 점수로 걸려들었다.
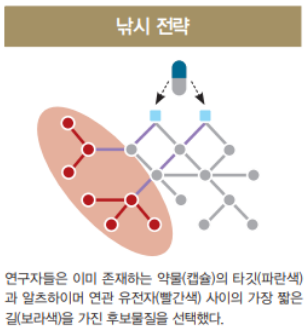
네트워크 기반 분석은 ‘마이크로어레이 유전자 발현’ 데이터를 이용해 유전체 간의 상호관계를 분석하며 어떤 유전체들이 서로 연결돼 있는지 통계학적으로 추론하는 것이다. 연구팀은 시판받아 사용 중인 약(캡슐)의 타깃(푸른색)과 알츠하이머 유전자(붉은색) 사이에 가장 짧은 구간(보라색)을 가진 후보물질을 선택하는 ‘낚시 전략ʼ을 사용했다(오른쪽 그림).
쥐를 모델로 사용한 연구에서 실데나필이 타우병증을 줄이고 기억력을 회복한다는 연구는 이미 보고된 바 있다. 쳉 박사 연구팀은 인간 뉴런 세포를 사용해 실데나필이 타우 단백질을 줄인다는 것을 보고하였다.
이런 데이터를 기초로 쳉 박사 연구팀은 7200만 명의 의료 기록을 분석하였다. 실데나필을 사용한 사람의 알츠하이머병 위험률이 무려 69% 정도 낮다는 것을 알아냈다. 쳉 박사는 이런 결과가 초기 알츠하이머 환자를 대상으로 임상 2상을 진행할 근거로 충분하다고 판단하였다.
실데나필은 ‘레바티오’라는 상품명으로 폐동맥고혈압(PAH) 치료에 사용되고 있다. 북미와 유럽 내에 PAH 환자 대부분은 21~50세의 여성이다. 비아그라는 남성만 사용하는 것으로 오해할 수 있지만 레바티오는 대부분 여성이 사용해 남녀 알츠하이머 환자 치료제로도 사용 가능하다.
알츠하이머병은 남성보다 여성 노인이 월등히 많다. 실데나필은 PDE5 저해제로 뇌혈관장벽(BBB)을 통과할 수 있다. 폐경기 여성의 알츠하이머병을 줄이기 위해 신약을 개발하는 동안 먼저 실데나필을 사용하는 방법이 합리적이다. 하지만 실데나필(브랜드명 비아그라) 외에도 타다라필(시알리스), 바데나필(레비트라), SK케미칼의 미로데나필(엠빅스, Mvix), 동아제약의 유데나필(자이데나), 일본 미쓰비시 타나베의 아바나필(스텐드라)까지 총 6개 PDE5를 억제하는 기전의 발기부전 치료제가 존재한다.
과연 어느 '필'이 안전성이 가장 좋을까? 실데나필은 일반적으로는 안전한 약물이지만, 안전성에 대한 주의가 필요하다. 고농도의 실데나필에 노출된 경우 시각이상의 빈도가 좀 더 높게 나타났다. 따라서 PDE isozyme들 중 PDE5에 대하여 높은 선택성을 보여 이상반응이 보다 적은 PDE-5 저해제를 선택하는 것이다. PDE1은 두통, PDE3는 심장관련 이상반응, 안구의 망막에 존재하는 PDE6는 일시적인 시각 장애, PDE11은 정자형성 감소와 관련이 있다고 보고되고 있다.
특히 미로데나필은 실데나필 등 다른 PDE-5 저해제들에 비해 PDE-5에 대한 선택성이 높아 PDE-1, PDE-6를 덜 억제한다. 실데나필 복용 시 'blue pill'이라고 부르는 일시적인 청색시증은 잘 알려진 비밀이다. 미로데나필은 안전성에 있어서 기존 발기부전 치료제의 일반적 부작용인 두통이 더 적게 나타났고 색각장애는 전혀 보고되지 않았다. 기존 경쟁품에 비해 현저히 낮은 부작용 발현율이 보고되었다.
최근인 2025년 4월 7일자 'npj Dementia'에 Masoud Bitaraf 연구팀이 'Phosphodiesterase‑5 inhibitors and Alzheimer’s disease; a meta‑analysis on clinical studies' 라는 제목의 논문이 출간되었다[https://www.nature.com/articles/s44400-025-00005-3].
연구팀은 알츠하이머병(AD)에 대한 PDE-5 억제제(PDE5I)의 잠재적 치료 효과를 평가하기 위해, Embase, Scopus, Medline의 전자 데이터베이스를 2024년 3월 18일까지 체계적으로 검색했다. PDE5I 사용과 AD 발생률 간의 연관성을 평가한 연구들이 포함되었다. 데이터 통합에는 제한적 최대우도 추정량의 확률효과모형(Random-effects model of restricted maximum likelihood estimator)을 사용했다.
483만3558명을 대상으로 한 7개 연구를 검토했으며, 그중 34만8546명이 PDE5I 중 하나로 치료를 받았다. 약물을 사용하지 않은 PDE5I 투여군(HR = 0.47, 95% CI 0.26–0.82, p값: 0.01)과 약물을 사용하지 않거나 AD 임상시험에 참여하지 않은 PDE5I 투여군(HR = 0.41, 95% CI 0.33–0.52, p값: <0.01)의 AD 발생률에 대한 통합 위험비(HR)를 계산했다. 종합된 증거는 PDE5I 투여가 AD 위험 감소와 관련이 있음을 시사하며, 이는 PDE5I의 3상 임상시험 시행을 뒷받침한다고 결론지었다.
Masoud Bitaraf 연구팀의 결론대로 대한민국의 아리바이오가 놀랍게도 알츠하이마병 임상 3상을 이미 진행 중이다. 이 사실을 확인 한 것이 지난 6월 13일 저녁이다. 필자가 오랫동안 잘 아는 A제약 대표를 통해 소개받은 아리바이오(AriBio Co., Ltd.) 프레드 김 지사장의 설명을 통해서다. 대한민국의 회사가 글로벌 3상을 진행한다는 것은 뜻밖의 일격이다. 그래서 임상 2상을 찾아보았다.
2021년 11월 25일 자 '디멘시아뉴스'는 아리바이오가 개발 중인 먹는 치매약 AR1001이 임상 2상에서 인지기능 악화 속도를 현저히 늦춘 것을 보고하였다.
"최근 보스턴에서 개최된 알츠하이머 임상학회(CTAD)에서 ‘AR1001’ 임상 2상의 책임자인 워싱턴대 의대 신경과 그릴리(Greeley) 교수가 맡았다. 아리바이오는 알츠하이머병 환자 210명을 대상으로 미국 21개 임상센터에서 총 12개월 간 진행했으며, 임상은 1차 임상시험 6개월과 2차 연장 시험 6개월로 나누어 진행됐다. 1년간 AR1001 10mg 또는 30mg을 투여한 결과, 첫 6개월 임상시험과 유사하게 약물 관련 중대한 이상 반응이 발견되지 않았을 뿐 아니라 발견된 이상 반응도 경미해 AR1001의 12개월 장기 안전성과 내약성에 대한 우수성이 충분히 확보됐다.
1차 유효성 평가지표인 ADAS-Cog 13(인지기능 평가지표)은 10mg 투여군의 경우 임상시험 시작점(Base Line)과 비교해 1.17점, 30mg 투여군은 0.76점 감소했다. 이는 12개월 동안 위약군이 약 5.5점 악화하는 것을 고려할 때 AR1001 투약에 의해 인지기능 악화 속도가 현저히 저하된 것을 의미한다. 다른 1차 유효성 평가지표인 ADCS-CGIC(인지, 행동 및 기능평가)도 시작점과 비교해 10mg 투여군은 0.13점, 30mg 투여군은 0.37점 저하됐다.
층화분석(Stratification Analysis) 결과 AR1001을 단독으로 복용했을 경우 30mg 투여에 의해 ADAS-Cog 13이 26주에 3.5점, 52주에 5.8점 향상됐다. 알츠하이머 진행 단계별로 볼 때 AR1001을 단독으로 복용한 경증도 환자군에서 10mg은 2.4점, 30mg은 8.7점으로 농도 의존적으로 향상돼 인지기능이 현저하게 좋아지는 결과를 얻었다. 또 다중요인 환자군의 경우 30mg 투여에 의해 9.2점 향상됐다.
2차 평가 지표인 NPI(신경정신행동검사), GDS(우울증상) 및 QoL(삶의질 평가)에서도 유사한 경향을 보여, 경증도 환자군과 AR1001 단독 투여군에서 더 좋은 효과를 나타냈다. 특히 우울증을 평가하는 GDS는 AR1001을 단독 투여한 30mg 투여군에서 1.57점 개선됐다. 아리바이오는 임상 2상 결과를 토대로 연내 FDA에 임상 3상 시험계획서를 제출하고, 내년에는 임상을 개시할 예정이다."
이런 임상 2상을 바탕으로 아리바이오는 AR1001의 임상 3상 시험을 2022년 시작하였고 현재도 진행중이다. 자세한 정보는 다음과 같다. 연구명: POLARIS-AD (NCT05531526), 연구 목적: 초기 알츠하이머병 환자에서 AR1001의 안전성 및 유효성 평가, 연구 디자인: 이중 눈가림, 무작위 배정, 위약 대조 연구, 참여 환자 수: 약 1150명, 진행 국가: 미국 및 한국 포함하여 13개국이다. 주요 특징은 67개 연구 사이트에서 환자 모집 진행하여 연구 중이다. 최종 탑라인 데이터는 2026년 상반기 발표 예정이고, 신약허가신청(NDA)은 2026년 하반기 제출 예정이다.
2026년이 벌써 기다려진다. 왜냐하면 지난 20년 동안 대한민국에 존재한 아리바이오 AR-1001의 최종 톱라인 데이터가 2026년 상반기 발표 예정이고 대한민국의 신약개발 회사가 미국 FDA에 신약허가신청(NDA)을 제출할 것이기 때문이다. Fingers crossed !
관련기사
- 보스턴서 각인된 AR1001..."경구형 AD 치료제, K-바이오가 만든다"
- 아리바이오 경구 알츠하이머 치료후보 'AR1001' 게임체인저 되나
- 노화는 혈류를 통해 퍼진다
- "100세인도 아밀로이드 함량 높을수록 인지 기능 저하 더 심화"
- 아리바이오 "AD 치료제 AR1001 중화권 상업화 파트너 푸싱제약"
- "중성지방은 뇌의 시냅스 기능을 위한 중요한 연료 저장소다"
- 여성이 남성보다 알츠하이머병에 걸릴 확률이 두 배 높은 이유
- 아리바이오 "임상3상 중간 경과 분석, 성공 기대 커졌다"
- SK케미칼-아리바이오, 치매 치료제 개발 업무협약 체결

