에브리스디 정제, 의료기관 방문ㆍ식사 관계 없이 자가 투약 가능
엔허투, HER2 발현 난소암ㆍ비소세포폐암 대상 3상 승인
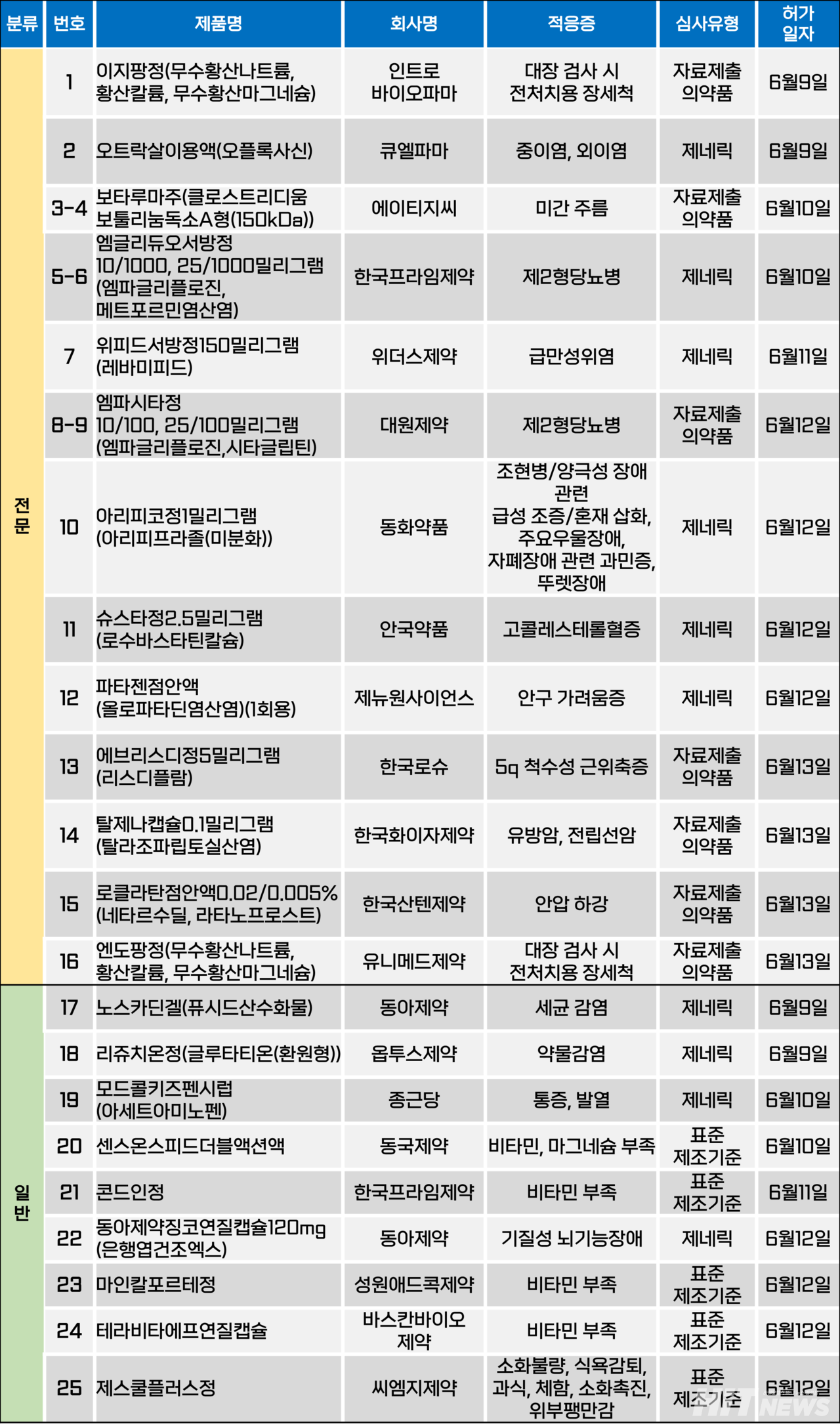
지난주(6월 9~13일) 총 25개 품목이 식품의약품안전처에서 품목허가를 받았다. 전문의약품 16개, 일반의약품 9개 품목이다. 이들은 미간 주름, 제2형당뇨병, 위염, 우울증, 고콜레스테롤혈증, 5q 척수성 근위축증 등 적응증으로 허가됐다.
5q(5번 염색체 장완) 척수성 근위축증 치료제 '에브리스디(성분 리스디플람)'의 정제 제형의 품목이 지난 13일 허가됐다. 해당 품목은 미국 식품의약국(FDA)로부터 지난달 12일(현지시간), 유럽 유럽의약품청(EMA)으로부터 지난 4일(현지시간) 허가된 바 있다.
에브리스디는 로슈의 자회사 '제넨텍(Genetec)'이 개발한 유아부터 성인까지 사용할 수 있도록 허가된 척수성 근위축증 치료제다. 5q 돌연변이로 인해 생존 운동 뉴런(Survival Motor Neuron, SMN) 단백질 결핍이 발생하는 척수성근위축증(SMA)을 치료하기 위해 개발됐다.
회사는 지난 2020년 11월 2일 식약처로부터 시럽 형태의 품목을 허가 받은 바 있다. 다만, 투여하기 전 의료전문가가 조제해야 하며, 매일 같은 시간 경구용 주사기를 통해 투여돼야 하는 불편함이 존재했다.
이번에 허가된 에브리스디 정제는 6.5mm 크기로 식사 여부와 관계없이 물에 녹이거나 삼켜 복용할 수 있다. 또한 상온에서도 보관이 가능하다. 자가 투약이 가능한 만큼 SMA 환자와 보호자에게 큰 편의성을 줄 것으로 기대되고 있다.
더불어 유아에게도 허가된 약제인 만큼, 여전히 기존 시럽 형태의 수요는 존재할 것으로 전망된다.
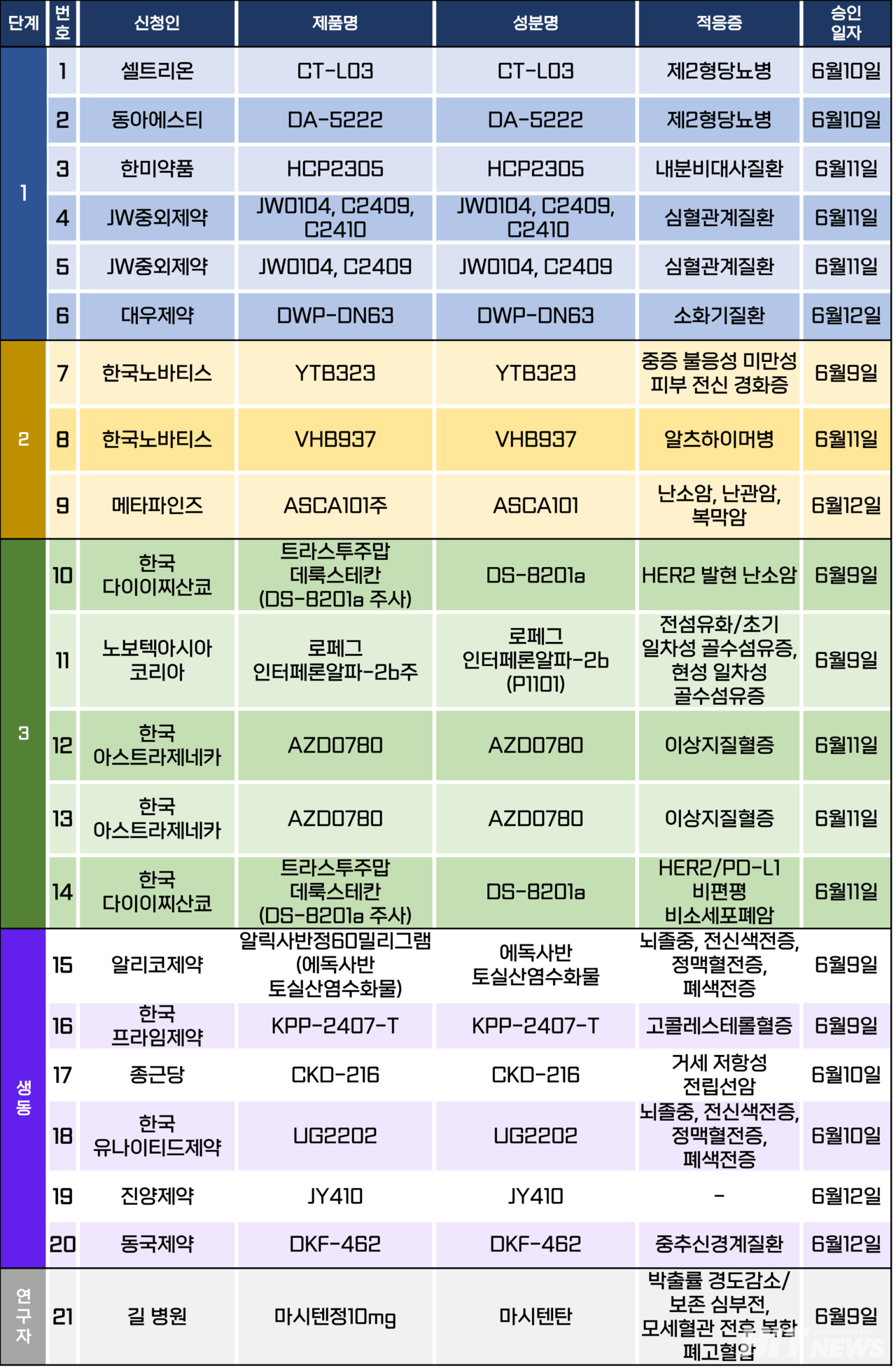
임상시험계획은 총 21건이 승인됐다. 세부적으로 △1상 6건 상 △2상 3건 △3상 5건 △생물학적 동등성 6건 △연구자 임상 1건 등이다. 이 임상시험들은 제2형당뇨병, 알츠하이머병, 피부 전신 경화증, 이상지질혈증 등 질환과 난소암, 난관암, 복막암, 비소세포폐암 등 암종을 대상으로 승인됐다.
다이이찌산쿄와 아스트라제네카가 공동 개발 중인 항체약물접합체(ADC) '엔허투(성분 트라스투주맙 데룩스테칸)'의 난소암 및 비소세포폐암 대상 3상 임상시험계획이 2건 승인됐다.
한국다이이찌산쿄는 지난 9일 HER2 발현 난소암에서 1차 유지요법으로서 엔허투와 베바시주맙(오리지널 아바스틴) 병용요법 대비 베바시주맙 단독요법에 대한 3상 임상시험계획(연구명 DESTINY-Ovarian01)을 승인받았다.
또, 지난 11일 국소 진행성 절제 불가능 또는 전이성 HER2 과발현 및 PD-L1 TPS 50% 미만 비편평 비소세포폐암 환자의 1차 치료로서 엔허투+키트루다 병용요법 대비 백금 기반 화학요법+키트루다 병용요법에 대한 3상 임상시험계획(DESTINY-Lung06)을 승인받았다.
DESTINY-Ovarian01 연구는 오는 2032년 1월까지 국내 환자 25명(글로벌 582명을 대상으로, 1차 유효성평가변수인 △치료 후 이상반응(TEAE), 심각한 이상반응(SAE), 특별관심대상 이상반응(AESI) 등 안전성 평가변수 △HER2 발현(IHC 3+/2+) 환자군에서의 무진행생존기간(PFS by 독립중앙맹검평가) 등을 평가한다.
DESTINY-Lung06 연구는 오는 2032년 6월까지 국내 환자 50명(글로벌 686명)을 대상으로, 1차 유효성평가변수인 PFS를 평가할 예정이다.
한편, 엔허투는 다이이찌산쿄의 독자적 DXd-ADC 플랫폼이 적용된 항암제로, △고효력 페이로드 △높은 약물-항체 결합 비율 △약물-항체 간 균일한 결합력 △종양 선택적 절단 링커 △안정적인 링커 구조 △짧은 페이로드 반감기 △인접 종양세포 사멸 효과(Bystander Effect) 등 7가지 장점을 가진다.
이 특성으로 엔허투는 현재 미국 FDA로부터 유방암 분야에서 6개 적응증을 허가 받았으며, 위암과 폐암 분야에서도 허가 범위를 넓혀가고 있다.

