안명주 교수, TROPION-Lung01ㆍLung05 연구 통합 분석 결과 발표
EGFR 변이 환자군 '전체' VS' 타그리소 실패군' 유사한 결과 보여

[싱가포르=황재선 기자] 아스트라제네카와 다이이찌산쿄가 개발하고 있는 항체약물접합체(ADC) 신약물질 '다토포타맙 데룩스테칸(Dato-Dxd)'이 EGFR 변이 비소세포폐암 환자의 2차 이상 치료에 있어 잠재적인 치료 옵션이 될 수 있다는 의견이 공유 됐다.

6일(현지시각) 싱가포르에서 진행된 유럽종양학회 아시안 연례학술대회(ESMO ASIA 2024)에서 안명주 삼성서울병원 혈액종양내과 교수는 이전에 치료받은 EGFR 돌연변이 진행성 비소세포폐암 환자에서 Dato-DXd의 효능 및 안전성을 확인한 2상 'TROPION-Lung05' 연구와 3상 'TROPION-Lung01' 연구의 통합 분석 결과를 공개했다.
이번 분석은 이전에 백금 기반 항암화학요법 또는 표적항암제로 치료받은 적 있는TROPION-Lung05 임상에서 117명, TROPION-Lung01 임상에서 39명 등 총 117명의 환자를 대상으로 이뤄졌다.
각 환자들이 보유하고 있는 EGFR 변이는 △엑손(Exon) 19 결손(51.3%)△Exon 21 L858R 치환(31.6%) △Exon 20 T790M 변이(27.4%) 등이었다.
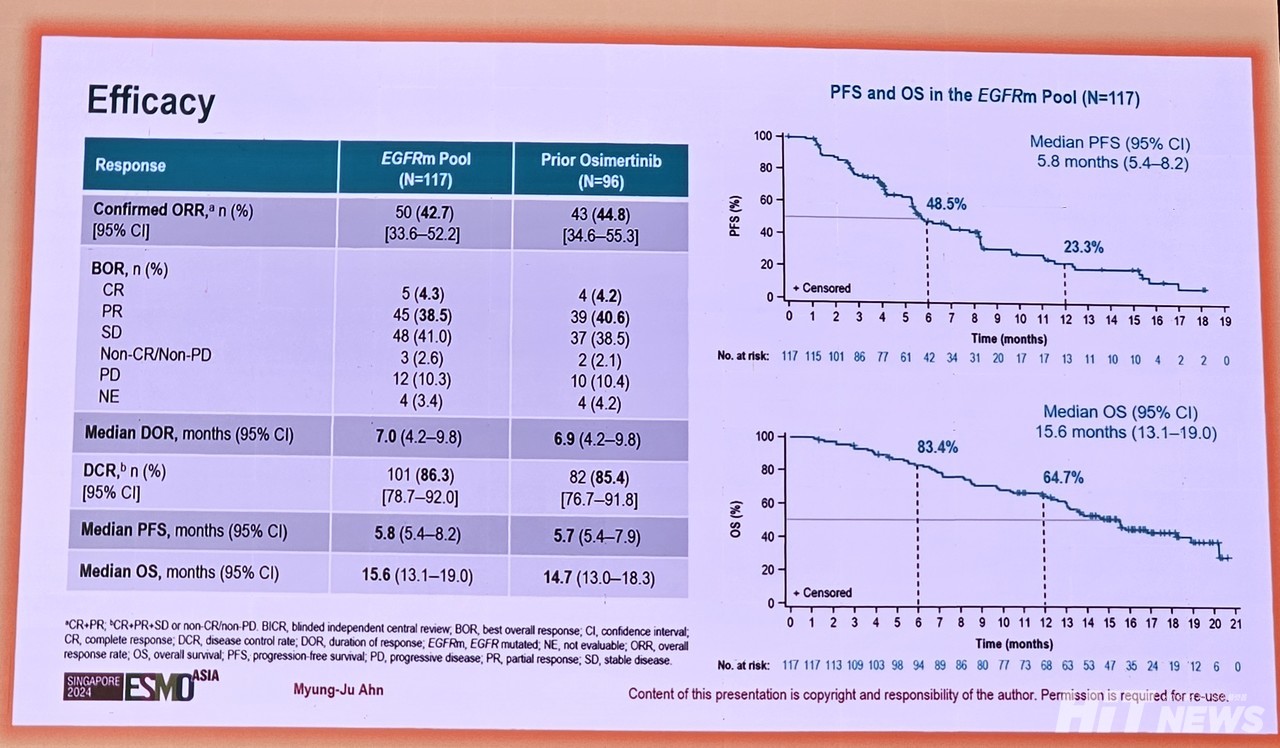
안명주 교수에 따르면, 이번 연구에서 독립 중앙 맹검 평가(BICR)를 통해 분석된 이들의 확증된 객관적반응률(cORR)은 42.8%(95% CI : 45-52), 반응 지속 기간(DoR) 중앙값은 7.0개월(95% CI : 4.2-9.8), 질병 통제율(DCR)은 86%(95% CI : 79-92)로 나타났다. 또, 무진행생존율(PFS) 중앙값은 5.8개월(95%CI : 4.2-9.8), 전체생존기간(OS) 중앙값은 15.6개월(13.1-19.0)으로 나타났다.
이 경향은 타그리소를 이전에 사용한 환자만을 별도 분석한 결과와도 유사했다. 이전에 타그리소를 사용한 환자 96명에서 corr 44.8%(95% CI : 34.6-55.3), DoR 중앙값 6.9개월(95% CI : 4.2-9.8), DCR 85.4%(95% CI : 76.7-91.8), PFS 중앙값 5.7개월(95% CI : 5.4-7.9), OS 중앙값 14.7개월(95% CI : 13.0-18.3) 등으로 분석됐다.

아울러 가장 빈번한 이상반응은 구내염/구강 점막염(전체 등급 69%, 3등급 이상 9%)이었으며, 4~5등급의 약물 관련 간질성 폐질환(ILD) 이상반응은 보고되지 않았다. 또, 약물과 관련된 사망 환자도 관찰되지 않았다.
안명주 교수는 "이번 연구를 통해 Dato-DXd는 2차 또는 그 이상의 EGFR 변이 비소세포폐암 치료에서 긍정적인 효능과 관리 가능한 수준의 안전성을 보였다"며 "이 결과를 바탕으로 미충족 수요가 존재하는 EGFR 변이 환자들에게 잠재적인 치료제로 사용할 수 있을 것으로 보인다"고 말했다.
한편, 아스트라제네카와 다이이찌산쿄 양사는 TROPION-Lung05 및 TROPION-Lung01 연구 결과들을 바탕으로 미국 FDA에 Dato-DXd를 EGFR 변이 환자의 2차 치료제로 허가심사를 진행 중이다.
유전자 분석을 통해 EGFR, ALK, ROS1, NTRK, BRAF, MET exon 14 skipping, RET 등 하나 이상의 변이를 가진 비소세포폐암 환자를 대상으로 한 TROPION-Lung05 연구에서 Dato-DXd는 완전 관해(CR) 4건, 부분 반응(PR) 45건을 포함해 35.8%의 cORR과 78.8%의 DCR을 보였다. PFS 중앙값은 5.4개월이었다. EGFR 돌연변이 환자에서는 43.6%의 ORR과 82.1%의 DCR을 보였다.
또, 이전에 치료를 받은 적 있는 비소세포폐암 환자를 대상으로 도시탁셀과 비교한 TROPION-Lung01 연구에서 각 PFS 중앙값 4.4개월(4.2-5.6), 3.7개월(2.9-42)로 유의미한 개선을 보였다.
다만, OS에서는 항암화학요법 대비 통계적 유의성을 확보하지 못했다(HR=0.94, 95% CI : 0.78-1.14, p=0.530). 특히 편평 세포암 환자군에서 데이터가 좋지 않았는데, PFS 중앙값은 2.8개월로 위약군 보다 1.1개월 짧았으며(HR=1.41, 95% CI : 0.95-2.08), OS 중앙값은 7.6개월로 위약군 보다 1.8개월 짧았다(HR=1.32, 95% CI : 0.91-1.92).
이에 회사는 기존 EGFR 변이 전체 환자군에서 유의미한 개선을 보인 EGFR 변이 비편평 비소세포폐암 환자군으로 대상을 좁히는 방향으로 허가 전략을 바꿨다.
지난달 12일 아스트라제네카 '수잔 갤브레이스' 항암제 연구‧개발부문 부회장은 "이 두 임상 결과를 통해 EGFR 변이 동반 환자들에게 효과적일 수 있을 것임을 입증할 수 있었고, Dato-DXd의 FDA 가속승인 신청을 결정할 수 있던 근거가 됐다"고 말했다.
관련기사
- 이중특이항체 '릴베고스토미그', 임상 3상서 키트루다와 비교
- 아스트라제네카, 'Dato-DXd' 병용 임상 종횡무진…ADC 시너지 노려
- AZ·다이이찌산쿄, 제2의 엔허투 '다토포타맙' 시동걸었다
- AZ ㆍ다이이찌 TROP2 ADC, FDA BTD 지정…환자군서 기회 포착
- "불치에 가깝던 '폐암' 치료, 타그리소 등장 전후로 나뉜다"
- Dr. Daniel Chan: FLAURA2 and the Future of NSCLC Treatment
- AZ, Daiichi’s TROP2 ADC Wins FDA Breakthrough Designation
- 다이이찌산쿄, '넥스트 엔허투' 다트포타맙 비소세포폐암 EU 승인신청 자진취하
- 다이이찌산쿄, 유방암 치료제 'DATO-DXd' 美 FDA 허가 획득
- [월간FDA] 브리노빈, DPP-4 억제제 성분 최초 액상 당뇨 치료제
- '엔허투'는 시작일 뿐… 'DXd' 적용 5개 ADC 개발 박차
- [월간 FDA] 새 조합 3제 고혈압 복합제 '위다플릭' 허가

