하이톡스, 2020년 수출용 허가 품목과 동일한 내수용 품목
사노피, IL-33 타깃 COPD 치료 신약후보 '이페테키맙' 3상 승인

지난주(1월 22~26일) 총 25개 품목이 식품의약품안전처로부터 품목허가를 받았다. 전문의약품은 17개 품목, 일반의약품은 8개 품목이었다. 이 의약품들은 미간 주름, 제2형 당뇨병, 발작, 치매 증후군, 고콜레스테롤혈증 등 다양한 적응증으로 허가됐다.
한국비엠아이가 개발한 보툴리눔 톡신 제제 '하이톡스주'가 지난 23일 허가됐다. 2005년 설립된 한국비엠아이는 제주특별자치도에 본사를 둔 헬스케어 기업으로, 주사제 제형의 전문의약품 및 필러 등 의료기기를 전문으로 개발하고 있다.
하이톡스주는 지난 2020년 회사가 수출용으로 허가 받은 클로스트리디움 보툴리눔 톡신 A형 제제 100단위 제품의 내수용 버전이다. 회사는 200단위와 50단위 수출용 제품을 작년 9월과 10월 허가받은 바 있다.
식약처는 이번에 하이톡스주를 '만 19세 이상 65세 이하의 성인에 있어서 눈썹주름근(Corrugator muscle) 그리고/또는 눈살근(Procerus muscle) 활동과 관련된 중등증 내지 중증의 심한 미간 주름의 일시적 개선'을 목적으로 사용할 수 있도록 허가했다.
한국비엠아이는 하이톡스주의 원료의약품부터 완제의약품까지 생산할 수 있는 생산공장을 제주에 보유하고 있다. 회사 측에 따르면, 제주공장은 완제 제조를 위한 감압 건조 공정을 시행해 제품의 안정성을 높였다. 또 2020년 산업통상자원부 장관으로부터 표창을 통해 보툴리눔 톡신 제제 생산기술에 대한 규정 준수와 생물 보안 관리 수준을 인정받은 바 있다.
이광인 한국비엠아이 대표는 지난 23일 보도자료를 통해 "하이톡스의 허가가 에스테틱 시장에서 한국비엠아이의 인지도 향상과 입지를 넓혀 기업의 큰 성장동력이 될 것으로 기대하고 있다"며 "혁신형 제약기업으로서 이번 기회를 통해 연구개발(R&D) 역량을 한층 강화하고, 본격적인 해외 시장 진출을 위한 경쟁력을 키우는데 더욱 집중할 것"이라고 전했다.
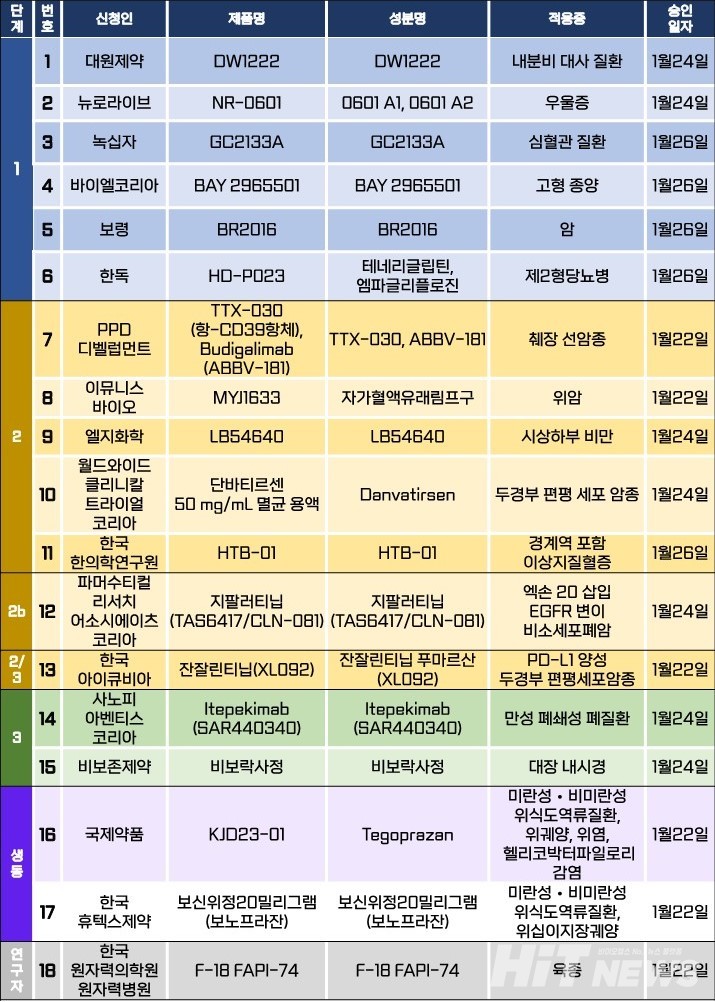
지난주 임상시험계획은 총 18건이 승인됐다. 세부적으로 △1상 6건 △2상 5건 △2b상 1건 △2/3상 1건 △3상 2건 △생물학적 동등성 2건 △연구자 임상 1건 등이다. 이 임상시험들은 내분비 대사질환, 우울증, 제2형 당뇨병, 시상하부 비만, 이상지질혈증, 만성 폐쇄성 폐질환 등 질환과 췌장 선암종, 위암, 두경부 편평세포암종, 비소세포폐암 등 암종을 대상으로 승인됐다.
사노피가 미국 '리제네론'과 개발 중인 만성 폐쇄성 폐질환(COPD) 신약물질 '이테페키맙(Itepekimab)'의 국내 3상 임상시험계획이 지난 24일 승인됐다. 이테페키맙은 체내에서 분비되는 신호 전달 물질 '사이토카인(Cytokine)'의 일종인 'IL-33(인터루킨-33)'을 타깃하는 단일클론항체로 개발되고 있는 물질이다. 회사가 COPD 치료제로의 적응증 확대를 시도하고 있는 '듀피젠트(성분 두필루맙)'가 IL-4 및 IL-13를 타깃하는 것과는 다른 기전을 가진다.
이번 임상은 과거 진행했던 이테페키맙의 3상 임상 시험인 'EFC16750', 'EFC16819' 연구에 참여했던 COPD 환자를 대상으로 진행하는 장기 안전성 및 내약성을 평가, 이중 눈가림 연장 임상시험이다. 국내 목표 참여 환자는 단 3명이지만, 글로벌로는 700명을 목표로 하고 있다. 2027년 5월 마치는 것을 목표로, 건국대병원에서 진행될 예정이다.
연구진은 이번 임상의 1차 유효성 평가변수(Primary endpoint)를 투여 후 발생하는 △AE(이상반응) △AESI(특별이상반응) △SAE(중대한 약물이상반응) △영구 투여 중단 등을 초래한 AE의 발생률 등으로 설정했다. 2차 유효성 평가변수(Secondary endpoint)는 △혈청 내 기능적 이테페키맙 농도 △투여 후 발생한(TE) 항약물 항체 반응의 발생률 △중등도 내지 중증 COPD 급성 악화의 연간 발생률(AECOPD) △중증 AECOPD의 연간 발생률 △첫 번째 중등도 내지 중증 AECOPD까지의 시간 △첫 번째 중증 AECOPD까지의 시간 △각 예정된 방문에서 아래 열거된 평가변수에 대한 모 임상시험(EFC16750, EFC16819)의 베이스라인 대비 변화 등이다.
한편, 사노피 본사는 작년 11월 말 자체 보도자료를 통해 듀피젠트의 COPD 대상 두 번째 3상 임상 시험인 'NOTUS' 연구에서 듀피젠트가 긍정적인 결과를 도출했다고 밝혔다. 회사는 1차 유효성 평가변수인 '52주 동안 중등도 또는 중증 COPD 악화 비율'을 약 34% 감소시켰다고 전했다.
연구 결과 발표와 함께 회사의 염증 및 면역학 부문 글로벌 개발 책임자인 나이미쉬 파텔(Naimish Patel) 박사는 "사노피는 COPD 환자의 미충족 수요(Unmet Needs)를 해결하기 위해 듀피젠트 연구를 멈추지 않을 것이고, 두 번째 프로그램인 이테페키맙의 주요 연구 데이터는 2025년에 발표할 수 있을 것으로 예상한다"며 "이 두 치료제는 재발성 악화를 겪고 있는 중등도ㆍ중증 COPD 환자의 약 80%가 사용할 수 있도록 개발될 것"이라고 밝힌 바 있다.

