한국비엠아이, 5번째 국산 데옥시콜산 성분 지방분해제 허가
CDR132L, 독일 제약사 '카르디오' 인수 후 도입 …miR-132 선택적 차단
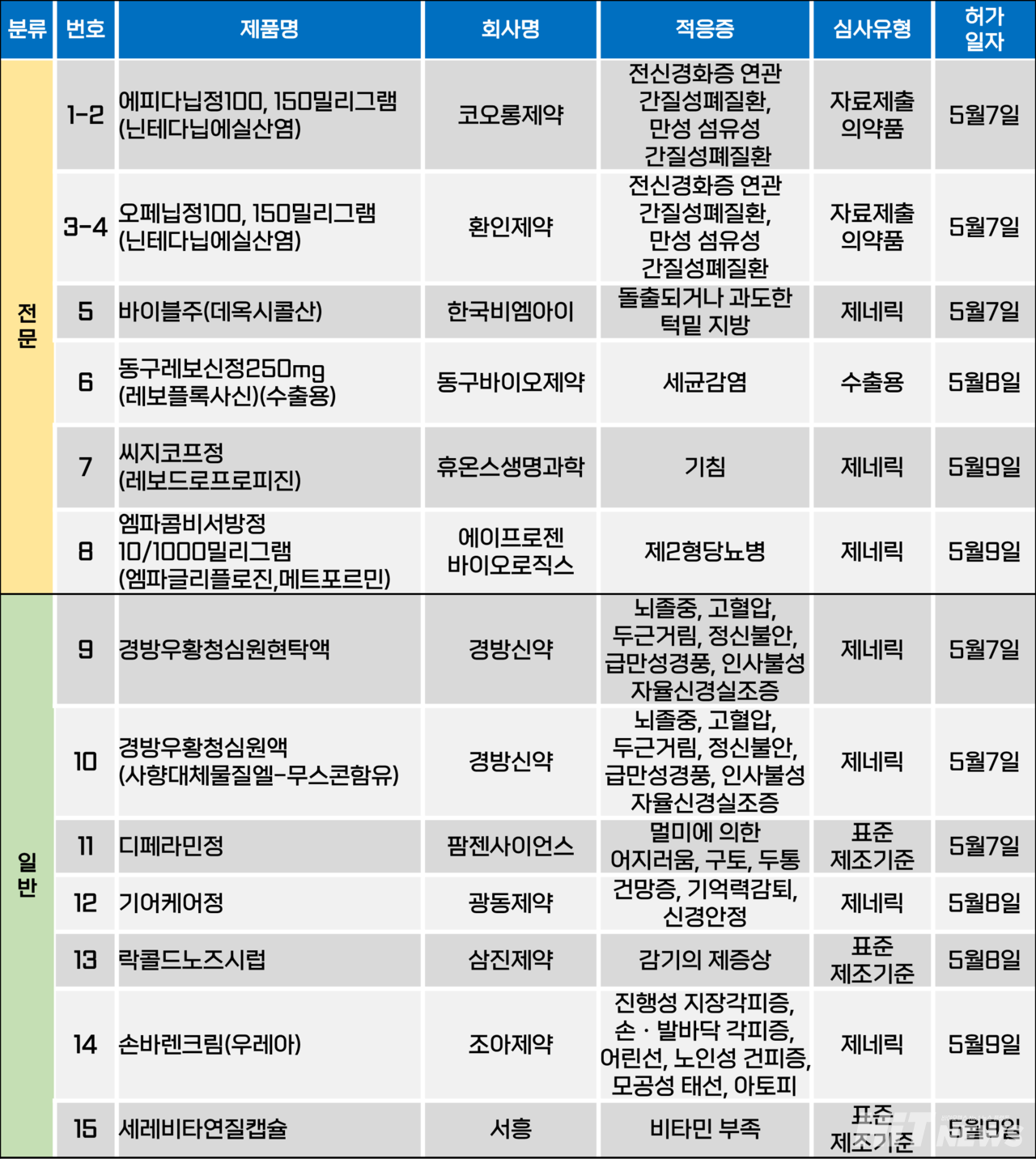
지난주(5월 5~9일) 총 15개 품목이 식품의약품안전처에서 품목허가를 받았다. 전문의약품 8개, 일반의약품 7개 품목이다. 이들은 간질성폐질환, 과도하거나 돌출된 턱밑 지방, 제2형당뇨병, 기침 등 적응증으로 허가됐다.
한국비엠아이가 5번째 데옥시콜산 성분 국산 지방분해 주사제를 허가받았다. 허가 적응증은 '성인의 중등증~중증의 돌출되거나 과도한 턱밑 지방의 개선'이다.
데옥시콜산 성분은 지방 소화를 돕는 담즙산의 일종이나, 미용 시술에서는 턱밑 지방(이중턱)의 제거를 위한 지방세포 주사제로 사용되고 있다.
현재 국내에 허가된 데옥시콜산 성분 제제로는 △브이올렛(대웅제약) △벨라콜린(LG화학) △펜카이라(펜믹스) △올리핏(휴메딕스) 등이 있다.
2017년 앨러간(현 애브비)이 동일 성분 제제 '벨카이라'를 출시했지만, 급여 문제 등 국내 시장 상황을 타개하지 못하고 2020년 12월 국내 철수를 결정했다.
그 공백을 기회로 바꾼 품목이 브이올렛이다. 대웅제약은 2021년 10월 브이올렛을 출시한 후 연 평균 165% 가량의 성장세를 이어가고 있으며, 전국 1500곳 이상의 병의원에 공급되고 있다(2024년 기준).
한편, 이번 바이블 허가 외에도 한국비엠아이는 에스테틱 시장 전문의약품 개발을 지속 추진하고 있다. 회사는 지난달 29일 자사 내수용 보툴리눔톡신 제제 '하이톡스'를 기존 100단위에서 200단위로 추가 품목허가받았다. 이 제품은 원료의약품부터 완제의약품까지 모두 제주 제2공장에서 생산되고 있다.
바이블과 하이톡스의 제품 라인업 확대의 시너지가 향후 국내 에스테틱 시장에서 점유율 양상에 어떤 영향을 미칠지 주목된다.
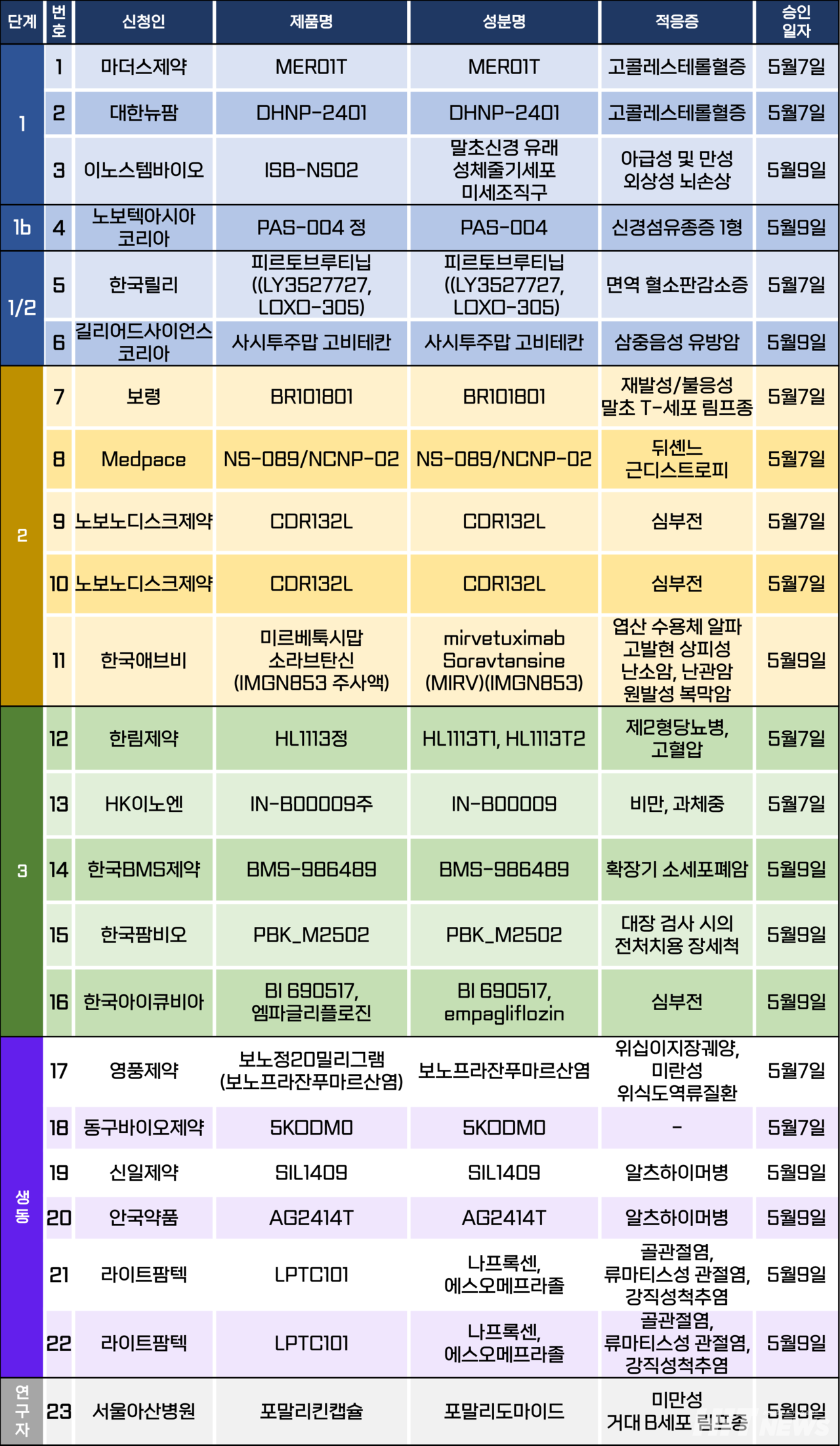
임상시험계획은 총 23건이 승인됐다. 세부적으로 △1상 3건 △1b상 1건 △1/2상 2건 △2상 5건 △3상 5건 △생물학적 동등성 6건 △연구자임상 1건 등이다. 이 임상시험들은 고콜레스테롤혈증, 외상성 뇌손상, 면역 혈소판 감소증, 심부전, 제2형당뇨병, 고혈압, 비만 등 질환을 대상으로 승인됐다.
노보 노디스크가 개발 중인 심부전 치료 신약 후보물질 'CDR132L'의 2상 임상시험계획 2건이 지난 7일 승인됐다.
심부전은 심장근이 정상적으로 수축 및 이완되지 못해 체내에 혈액과 산소 필요량을 충분히 전달하지 못하는 질환이다. CDR132L은 비정상적인 수준의 microRNA(miRNA) 분자 'miR-132'를 선택적으로 차단해 심장 기능의 장기적인 개선을 유도하는 안티센스 올리고핵산(Anti-sense Oligonucleotide, ASO)으로서, 차세대 심부전 치료제로 개발되고 있다.
이번에 승인된 임상시험들은 △박출률 보존 및 좌심실 비대를 동반한 심부전 △박출률 감소/경도 감소 및 좌심실 비대를 동반한 심부전 환자에서 심장 역 재형성에 대한 CDR132L의 안전성 및 유효성을 확인하기 위한 무작위 배정, 이중 눈가림, 위약 대조 연구다.
두 연구 모두 국내 15명(글로벌 200명)의 환자 참여를 목표로 △연세대 세브란스병원 △충북대병원 △고려대 의대부속병원 △연세대 원주세브란스기독병원 △계명대동산병원 등 의료기관에서 2028년 12월까지 진행될 예정이다.
환자들은 시험약 또는 위약을 4주마다 1회 정맥 내에 주입받으며, 이번 임상의 1차 유효성평가변수인 베이라인부터 제24주까지의 체내 miR-132의 변화를 평가받게 된다.
한편, 이번 CDR132L의 2상 임상시험은 지난 3월 25일(현지시간) 노보 노디스크가 독일의 심장 질환 전문 제약사 '카르디오르 파마슈티컬스'를 인수하면서 추진됐다. 당시 노보 측은 최대 10억2500만유로에 카디오르를 인수했다고 밝혔다.
과거 유럽 심장 저널에 게재된 연구 결과에서 CDR132L은 1상 임상시험에서 안전성 및 내약성 그리고 위약 대비 심부전 환자의 심장 기능 개선이 확인된 바 있다.
CDR132L에게 이번 2상 임상시험이 처음은 아니다. 국내에서는 진행되지 않았지만, 이미 일부 해외 국가에서는 2상 임상시험인 'HF-REVERT' 연구가 진행중에 있다. 이 연구는 이전에 심장마비(심근경색)을 경험한 적이 있는 박출률 감소 심부전 환자 280명을 대상으로 하며, 2022년 7월 첫 환자가 투여됐다.
노보 노디스크는 그동안 당뇨병, 비만, 성장 장애 및 일부 희귀질환에 초점을 맞춘 제품을 선보여왔다. 그러나, 현재 심혈관 질환과 더불어 대사이상 지방간염(MASH) 등 분야 치료제도 주요 파이프라인도 개발 중인 것으로 나타나 향후 회사의 시장 영향은 더욱 확대될 것으로 전망된다.

