식약처 16일 의약품 정보 서한 배포, 다른 의약품으로 대체 당부
의약품 안전평가과 "중앙약심결과, 안전성에는 문제 없어"

2015년부터 7년 동안 임상시험 재평가를 이어온 뇌기능개선제 '옥시라세탐' 제제가 끝내 효과성을 입증하지 못했다. 임상시험 재평가는 '약사법' 제33조에 따라 허가 효능·효과에 대해 최신 과학 수준에서 효과성을 재평가하는 절차다.

식품의약품안전처는 임상시험 재평가 결과 '혈관성 인지 장애 증상 개선'에 대한 효과성을 입증하지 못한 옥시라세탐 제제에 대해 처방·조제를 중지하고 대체의약품 사용을 권고하는 의약품 정보 서한을 16일에 배포했다.
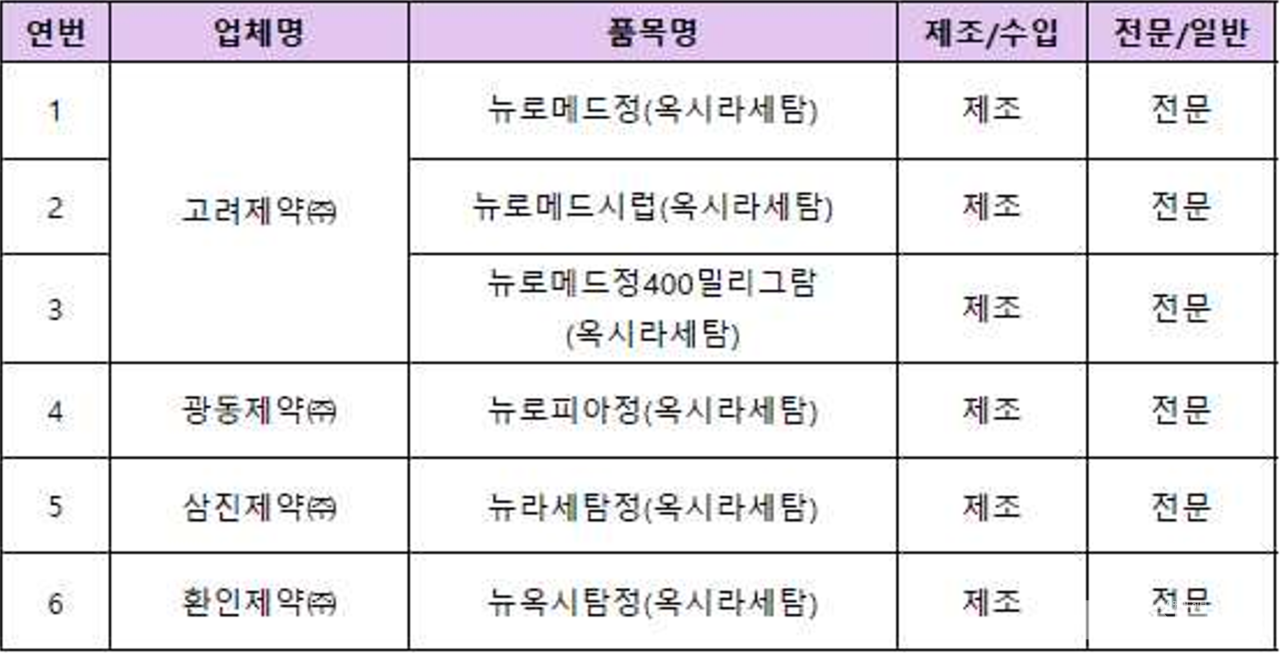
이번 조치 대상은 △뉴로메드정(고려제약) △뉴로메드시럽(고려제약) △뉴로메드정400밀리그람(고려제약) △뉴로피아정(광동제약) △뉴라세탐정(삼진제약) △뉴옥시탐정(환인제약) 등 6품목이다.
신경승 식약처 의약품안전평가과장은 "이번 조치는 최근 업체가 식약처에 제출한 임상시험 결과에 대해 식약처 검토와 중앙약사심의위원회 자문을 거쳐 종합·평가한 결과"라며 "대상 제제들은 안전성에는 문제가 없으나 효과성을 입증하지 못한 것으로 나타나 이후 절차 진행에 앞서 선제적 조치를 하기 위한 것"이라고 밝혔다.
식약처는 이후 '의약품 재평가 실시에 관한 규정' 고시에 따라 △재평가 시안 열람(20일) △이의신청 기간(10일) 부여 △적응증 삭제 결과 공시 등의 후속 행정절차를 진행할 예정이다.
이번 배포된 의약품 정보 서한은 의·약사 등 전문가가 ‘혈관성 인지 장애’ 환자에게 대체의약품을 사용하도록 협조해 줄 것을 요청하고 있으며, 이 성분 제제를 복용하고 있는 환자들에게는 의·약사와 상의할 것을 당부하고 있다.
또한, 보건복지부와 건강보험심사평가원 등에 병·의원과 약국이 해당 품목을 처방·조제 시 유의하도록 협조해줄 것을 요청했다.
한편 옥시라세탐 성분은 올해 급여적정성 재평가 대상 성분으로, 임상 재평가 결과에 따라 급여적정성 재평가 여부에 관계 없이 급여가 삭제될 수 있는 상황이었다.
이의신청 기간이 남아있지만, 만약 이마저도 받아들여지지 않는다면 단기일 내 급여삭제가 진행돼 급여적정성 재평가는 진행되지 않을 것으로 전망된다.

