"대부분 이상 반응은 12개월 내 발생, 주요 반응 중 중대사항 없어"
"1B~3A기 EGFR 변이 NSCLC 환자, 장기 보조요법 기준 설정 도움될 것"
[ESMO ASIA 2022(싱가포르) = 황재선 기자] 타그리소(성분명 : 오시머티닙)의 초기 EGFR 변이 전이성 비소세포폐암(NSCLC)에서 수술 후 보조요법에 대한 장기 안전성 관찰 연구(ADAURA) 3상 임상 결과가 발표됐다.
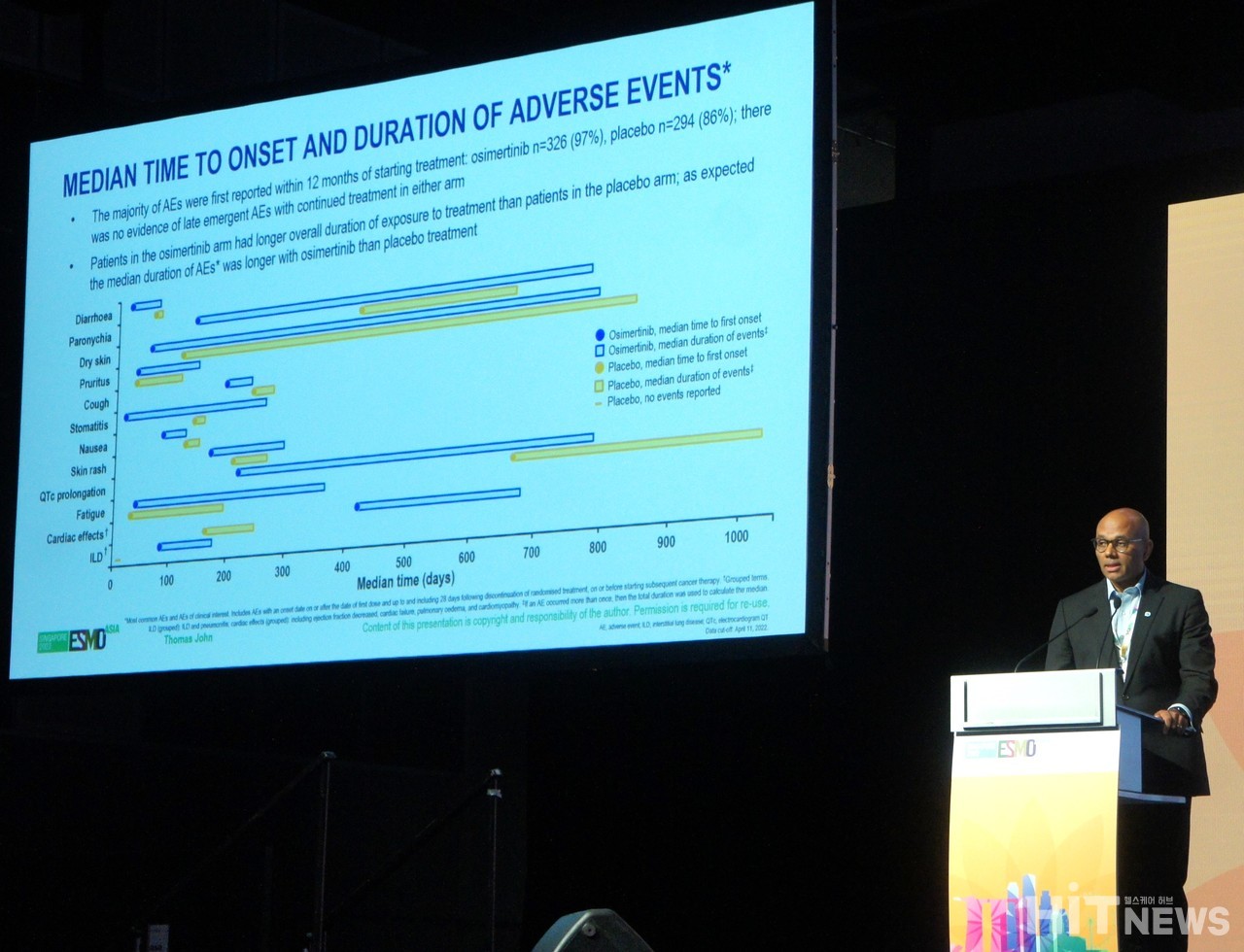
Thomas John 호주 Peter MacCallum Cancer Centre 종양학과 교수는 3일 ESMO ASIA 2022 소규모 구두발표 세션에서 "오시머티닙 투약군은 장기간의 치료 기간을 잘 버틸 수 있었다"며 "대부분의 이상반응(Adverse Event)은 치료 후 12개월 이내에 발생했고(오시머티닙군 97%, 위약군 86%), 그 이후는 적은 비율로 발생했다(오시머티닙군 1%, 위약군 4%)"고 발표했다.
이어 "연구 결과, 성별에 따른 이상반응 발생률에 유의미한 차이는 없었으며, 이번 연구 데이터가 오시머티닙을 1B~3A기 EGFR 변이 NSCLC 환자의 장기 보조요법 기준으로 설정하는 데 도움을 줄 것으로 생각한다"고 설명했다.

AUDRA 연구는 1B~3A기 EGFR 변이 NSCLC 수술 환자 682명(글로벌)을 대상으로, 타그리소 수술 후 보조요법군(339명)과 위약군(343명)으로 무작위 배정해 진행됐다.
안전성 평가는 기저치(Baseline)인 2, 4, 12주, 치료가 완료/중단될 때까지 12주마다, 치료가 중단된 후 28일 째 수행됐으며, 1차 평가지표는 무병생존기간(DFS)로 설정됐다.
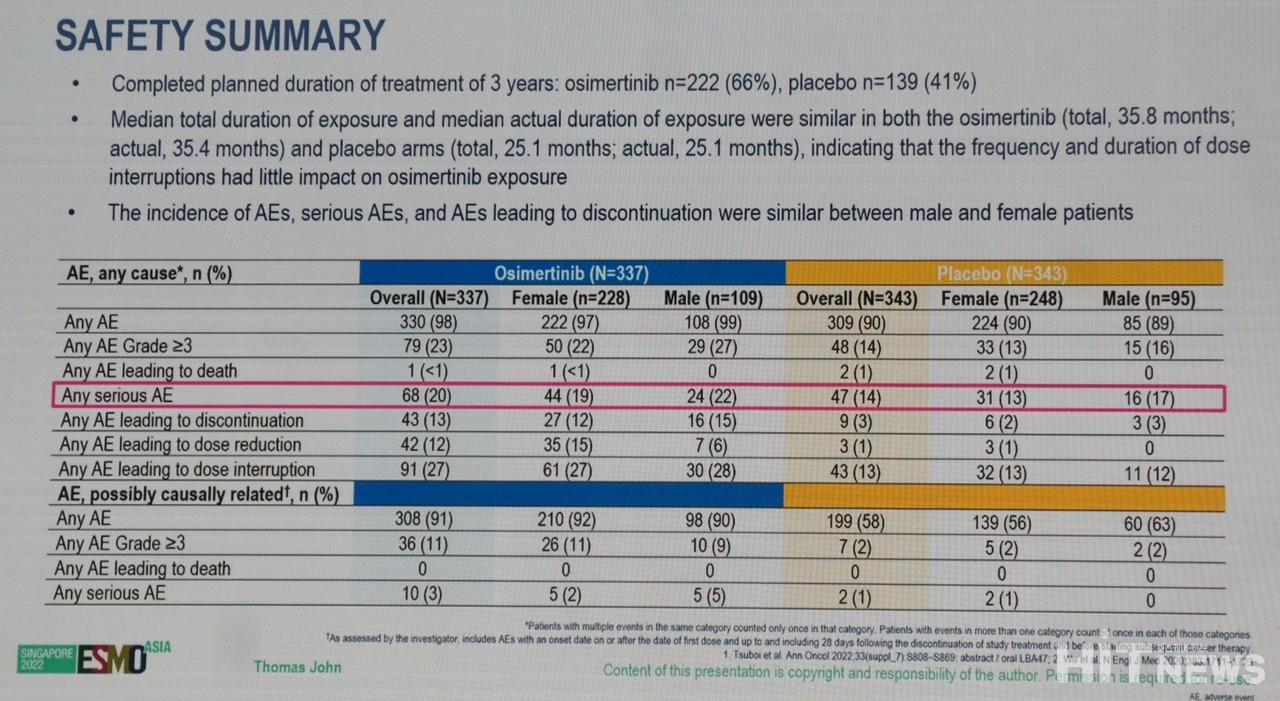
Thomas 교수에 따르면, 공개된 오시머티닙군의 추적관찰 기간은 35.8개월이었으며, 위약군은 25.1개월이었다. 이 기간동안 보고된 중대이상반응(Serious Adverse Event)는 각 68, 47건이었다.
그는 "오시머티닙의 주요 이상반응들은 중대하지 않았으며, 이상반응으로 인한 투여 중단(Discontinuation) 및 감량(Reduction)은 오시머티닙군이 43(13%), 42(12%)건, 위약군이 9(3%), 3(1%)건으로 나타났다"고 밝혔다.
가장 많이 보고된 투여 중단 사례는 ILD(간질성폐질환), 투여 감량의 경우 구내염으로 나타났다.

