안재용 대표 "글로벌 최초 출시보다 늦더라도 확실한 검증"
SK 코19 재조합 백신 1상 · 동화 코19 치료제 2상 각각 승인

한눈에 보는 임상 승인·품목 허가 - 11월 4주 차 (11.23.~29.)
"글로벌에서 최초로 출시되는 백신보다는 다소 늦더라도 안전성과 유효성이 확실히 검증된 코로나19 백신을 만드는 게 우리 목표다."
안재용 SK바이오사이언스 대표는 자사 코로나19 백신 후보물질 'NBP2001' 1상 임상시험 계획(IND)을 식품의약품안전처로부터 승인받은 소식을 전하며 24일 이같이 밝혔다. 글로벌 제약사들이 코로나19 백신 임상을 진행해 그 결과를 발표하는 가운데, 늦더라도 국산 코로나19 백신 개발에 성공하겠다는 의지로 풀이된다.

동화약품도 코로나19 치료제로 개발 중인 후보물질 임상 2상을 승인받았다. 수출을 계획하고 수출 허가를 받는 국내 제약사들 사례도 눈에 띈다.
SK와 동화약품, 코19 종식 기여할 백신·치료제 개발 박차
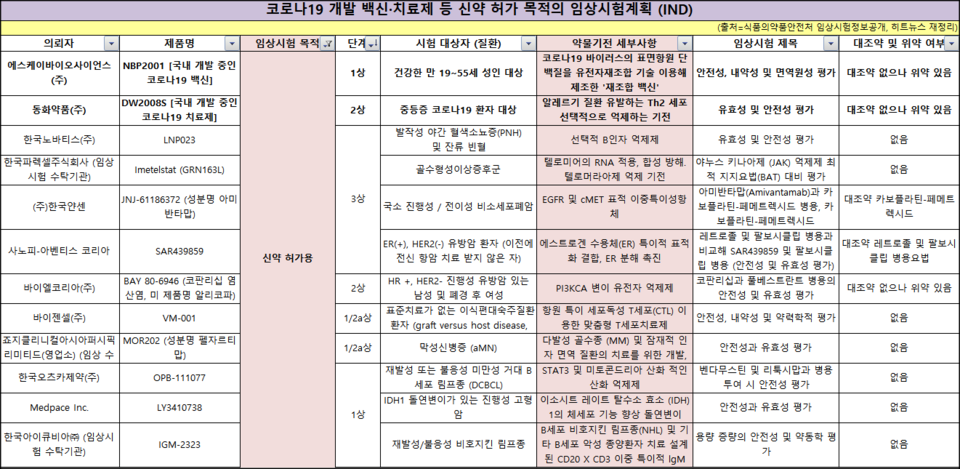
한 주간의 임상시험은 18건으로 목적에 따라 ▲신약 허가용 12건 ▲제네릭 허가 5건 ▲연구용 임상 1건이다. ▲1상 5건 ▲3상 4건 ▲생동 4건 ▲1/2a상 2건 ▲2상 2건 ▲연구 1건이다.
국내에서 개발되는 코로나19 백신·치료제 후보물질 임상이 2건 신규 승인받았다. 식품의약품안전처에 따르면, 현재 국내에서 코로나19 관련해 승인한 임상시험은 총 30건으로, 이 중 22건이 진행 중에 있다.
SK바이오사이언스 코로나19 백신 후보물질 'NBP2001'의 임상 1상이 지난 23일 승인됐다. 건강한 성인에게 안전성 및 면역원성을 평가한다. NBP2001은 코로나19 바이러스의 표면항원 단백질을 유전자재조합 기술로 제조한 '재조합 백신'이다.
백신 표면 항원 단백질이 면역세포를 자극해 면역반응을 유도하며, 코로나19 바이러스가 침입하는 경우 항체가 코로나19 바이러스를 제거한다. 회사는 영장류 대상 효력 시험에서 코로나19 완치자 혈청보다 10배 높은 중화항체를 유도했고, NBP2001을 통해 중화항체가 유도된 시험군에서 기도와 폐 등 호흡기에서 바이러스 증식을 차단하는 방어능력을 확인했다.
설치류 대상 비임상 독성시험에서도 안전성을 확인했었다. SK바이오사이언스는 단백질 배양과 정제 과정을 거친 합성항원백신이라는 점에서 안전성을 입증하는 데 유리할 것으로 기대하고 있다. 개발 완료 즉시 백신 공장 안동L하우스에서 대량생산 가능한 점도 SK의 장점이다.
동화약품은 코로나19 치료제로 개발 중인 후보물질 'DW2008S'의 임상 2상을 23일 승인받았다. 중등증 코로나19 환자 대상으로 유효성 및 안전성 평가에 착수할 계획이다. DW2008S은 천식치료 신약으로 개발하던 천연물의약품으로, 이번 임상으로 새로운 항바이러스 효과를 탐색해 코로나19 치료제로서의 가능성을 확인할 예정이다.
보령제약 관계사인 면역세포치료제 개발 기업 바이젠셀은 이식편대숙주질환(GVHD)에 대한 면역억제 세포치료제 'VM-001'의 임상 1상을 승인받았다. 안전성, 내약성 및 약력학적 평가를 할 예정이다. 이식편대숙주질환(GVHD)은 백혈병, 골수종, 림프종 등과 같은 혈액암 치료 시, 동종 조혈모세포를 이식하던 중 발생하는 합병증으로 근본적 치료제가 없었다.

바이젠셀은 범용 면역조절 세포치료 플랫폼 기술 '바이메디어(ViMedier)'을 통해 후보물질 'VM-001'을 도출했다. 항원 특이 세포독성 T세포(CTL)를 이용해 맞춤형 T세포치료제를 개발 중인 바이젠셀은 지난 9월 보령제약과 면역세포치료제 연구개발(R&D) 업무협약(MOU)을 체결했다. 개발과 상업화를 촉진할 계획이다.
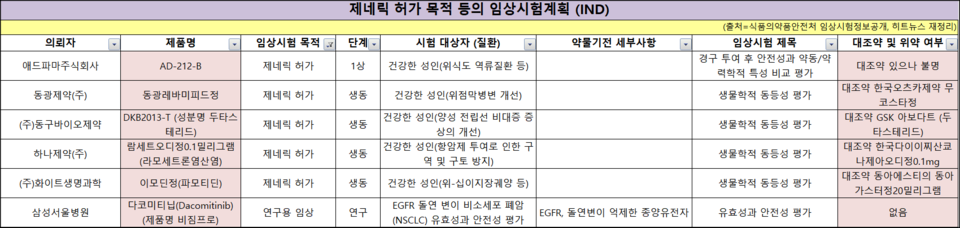
'슈가메트' · '리엔톡스' 수출 허가받으며 글로벌 진출 타진
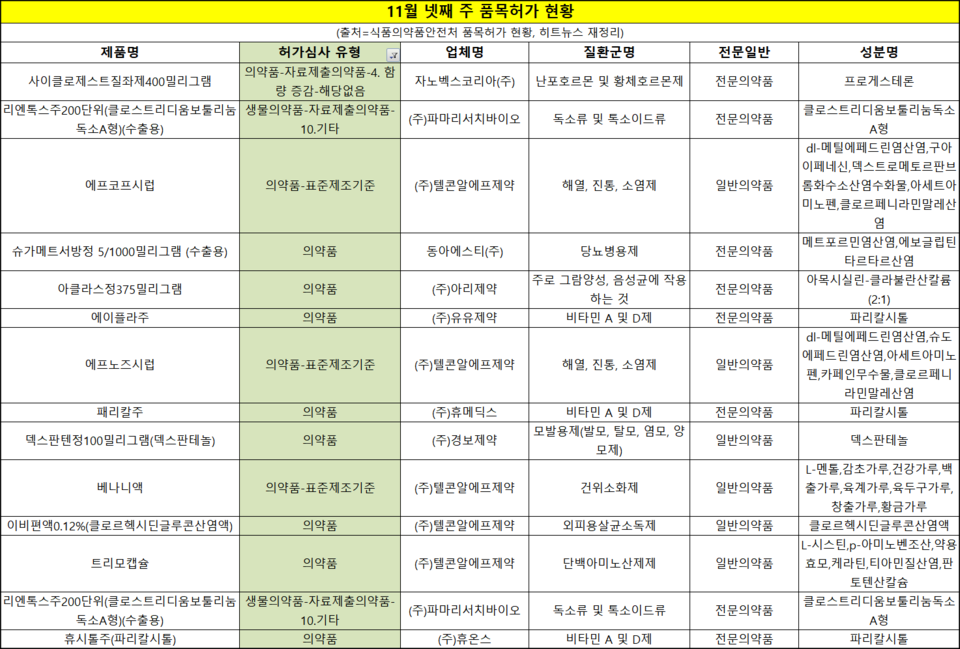
한 주동안 44품목이 허가받았고 ▲전문의약품 23품목 ▲일반의약품 21품목이었다. 허가심사유형상 신약은 없었고 자료제출의약품이 2품목 있었다. 동아에스티와 파마리서치는 각각 당뇨 신약과 보툴리눔 톡신 수출용 허가로 글로벌 진출에 나선다.
동아에스티는 지난 27일 '슈가메트5/1000mg(성분명 에보글립틴/메트포르민)'의 수출용 허가를 받았다.
슈가메트는 동아에스티의 DPP-4 억제제 계열 당뇨병 신약 슈가논에 메트포르민을 결합한 복합제로 지난 2016년 출시됐다.
적은 용량으로도 우수한 혈당강하 효과를 보여 복약 순응도를 높이고, 신장 장애 환자에 용량 조절없이 사용 가능하다는 점을 발휘했다.
HK inno.N(구 CJ헬스케어)와 코프로모션을 하며 올 3분기까지 175억 원의 판매를 기록했다.
동아에스티는 슈가메트의 수출용 허가는 슈가논 기존 기술수출 계약에 따른 조치라고 했다. 지난 2012년부터 인도, 네팔을 비롯 2015년 남미 17개국과 러시아 포럼 CIS 3개국에 기술수출 계약을 체결했었다. 러시아에서는 올 2월부터 판매되고 있으며 브라질에서는 신약 허가신청(NDA)을 마쳤다. 이번 수출은 향후 중남미 국가에 수출하기 위한 목적의 허가라고 했다.
파마리서치프로덕트 자회사 파마리서치바이오는 보툴리눔 톡신 제제 '리엔톡스주200단위' 수출용 허가를 받았다. 지난해 2월 100단위에 이어 이번에 200단위 허가도 획득했다. 현재 미등록 수출국에 제품을 판매 중이다.

지난해 10월에는 LG화학과 라이선스 계약을 맺고 중국 시장 진출을 계획하고 있다. LG화학은 리엔톡스의 중국 내 임상시험 실시, 허가 및 독점 판매를 맡고 국내 시장은 양사 공공동 판매할 예정이다.
파마리서치바이오는 리엔톡스 국내 출시도 박차를 가하고 있다. 지난 6월, 3상 임상을 승인받아 진행 중이며 내년 말까지 품목허가 받고 국내 출시할 계획이다. 회사는 향후 리쥬란, 리쥬비엘 등 파마리서치 에스테틱 포트폴리오와 함께 국내 외 시장 점유율을 늘려나갈 계획이다.
최근 들어 파리칼시톨 성분의 이차적 부갑상샘 기능항전증 제네릭 허가가 늘었다. 애브비의 '젬플라주'가 오리지널인데 올 1월 보령제약이 퍼스트제네릭으로 제품을 낸 이후 휴온스 등도 가세했다.
파리칼시톨 제제 오리지널 젬플라는 지난해 아이큐비아 기준 100억 원의 판매고를 올렸다. 제네릭 출시로 의료현장에서 처방 가능한 약물 선택의 영역이 넓어졌다. 휴온스는 추후 다른 업체에 수탁생산을 맡아 허가획득을 도울 전망이라, 향후 시장 판세는 지켜봐야 할 전망이다.

