이보세니맙, 中 아케소 개발 PD-1 x VEGF 타깃 이중항체 신약
3상 'HARMONI' 결과, PFS 중앙값 6.8개월, OS 16.8개월 확인
"모든 하위군 분석에서 일관된 효과, 뇌전이 보유 환자서 혜택 커"

[바르셀로나(스페인)=방혜림 기자] 미국 서밋테라퓨틱스와 중국 아케소가 개발중인 이중항체 신약 후보물질 '이보네시맙'이 EGFR-TKI 치료에 실패한 EGFR 변이 진행성 비소세포폐암(NSCLC) 환자의 2차 치료에서 질병 진행 또는 사망 위험을 48% 감소시킨 것으로 나타났다.
이보네시맙은 PD-1과 혈관내피성장인자(VEGF)를 표적하는 이중항체 치료제다. 지난해 5월 중국 품목허가를 획득했고, 미국 식품의약국(FDA)에서 패스트트랙 약제로 지정받아 허가 심사를 진행하고 있다.
7일(현지시간) 세계폐암학회(WCLC)에서는 이보네시맙+항암화학요법군(카보플라틴+페메트렉시드)과 위약+항암화학요법군의 안전성 및 유효성을 비교하는 3상 임상 'HARMONI' 연구 데이터가 발표됐다.
이 연구에 참여한 EGFR 변이 양성 NSCLC 환자 438명 중 273명은 중국 환자, 165명은 북미 및 유럽 환자였으며, 약 24.7% 환자에서 뇌전이가 확인됐다. 주요 유효성평가변수는 독립적 방사선 검토 위원회(IRRC)에 의한 무진행생존기간(PFS)이었다.
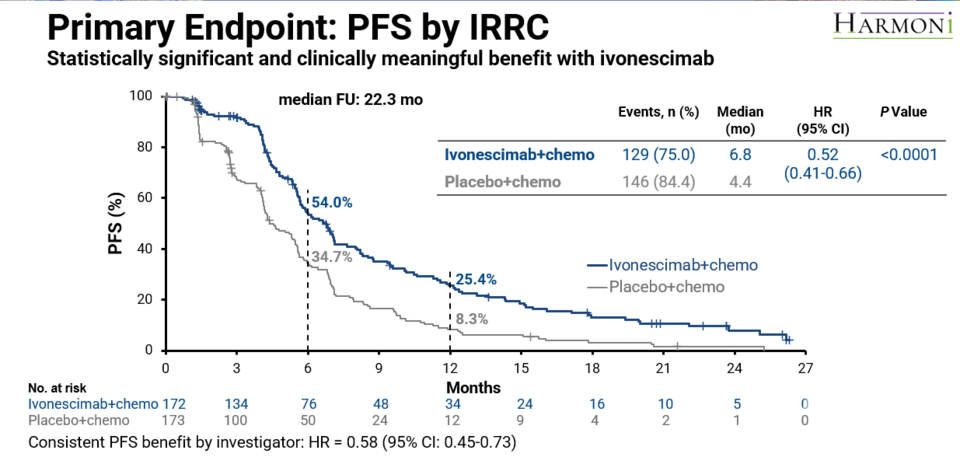
연구 결과(중앙 추적 기간 22.3개월 시점), 이보네시맙 투여군의 PFS 중앙값(mPFS)은 6.8개월(95% CI: 5.7-7.1)로, 대조군의 4.4개월(95% CI: 4.1-5.5) 대비 48%의 질병 진행 또는 사망 위험 감소 혜택을 보였다(HR 0.52, 95% CI : 0.41-0.66, p<0.0001).
뇌전이 보유 환자에서 그 효과는 더 크게 나타났다. 이 환자군에서 이보네시맙 투여군은 대조군 대비 질병 진행 또는 사망 위험을 66% 감소시킨 것으로 나타났으며, 그 경향은 서양 환자를 포함한 모든 사전 정의된 하위 분석군에서 일관되게 나타났다.
최종 전체생존기간(OS) 분석에서, OS 중앙값(mOS)는 16.8개월로(95% CI: 14.3-19.0), 대조군 14.0개월(95% CI: 14.3-19.0) 대비 2.8개월의 연장을 보였다. 객관적 반응률(ORR)은 이보네시맙 투여군이 44.7%, 위약군이 34.2%로 관찰됐으며, 인종별 약동학적 프로파일은 유사하게 나타났다.
3등급 이상의 치료 관련 이상반응(TRAE)은 이보네시맙군에서 50.0%, 위약군에서 42.2%에서 나타났고, 임상 중단은 각 7.3%, 5.0%로 보고됐다.

조나단 골드만(Jonathan Goldman) 미국 캘리포니아 UCLA 의대 교수는 "이보네시맙 병용요법은 3세대 EGFR-TKI 치료 이후 치료에서 임상적·통계적으로 유의미한 PFS 연장 혜택을 보였다"며 "뇌전이 보유 여부 및 지역에 관계없이 일관된 유효성이 관찰됐으며, 전체 생존 연장이라는 긍정적인 경향도 확인됐다"고 평가했다.

