식약처, 조정 신청 대상 모든 사항으로 확대 등 개정 안내서 발간

식품의약품안전처(처장 오유경)는 '의약품 허가·심사 조정협의체'의 신청 기한을 연장하고 대상을 확대했다는 내용의 민원인 안내서를 8월 29일 발간했다고 밝혔다.
'의약품 허가·심사 조정협의체'는 의약품안전국장 주재 식약처 내·외부 전문가로 구성된 기구다. 의약품(바이오의약품 제외) 품목허가·심사 과정의 자료 보완 요구와 관련해 신청인이 조정을 신청하는 절차다.
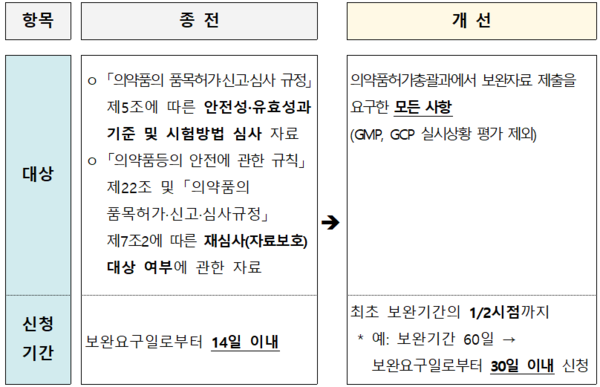
식약처는 이번 안내서 개정을 통해 △업체의 조정 신청 기한을 보완 요구일로부터 기존 14일에서 30일로 연장하고 △조정 신청 대상을 기존 안전성·유효성 심사자료, 품질 심사자료, 자료보호 대상 여부에 관한 자료에서 제조 및 품질관리기준(GMP), 임상시험 관리기준(GCP) 심사를 제외한 모든 보완요구 사항으로 확대한다.
식약처 측은 "신청인이 자료 보완요구 조정을 신청하면 식약처는 사전심의를 거쳐 협의체 안건으로 선정한다"며 "조정 대상으로 선정된 안건은 내외부 전문가로 구성된 조정협의체 회의에서 심도 깊은 토의를 거쳐 보완 사항에 대한 조정 결과를 도출하여 관련 부서 및 조정 신청인에게 통보된다"고 밝혔다.
이어 "조정협의체 확대·개선 운영이 의약품 허가·심사 과정에 대한 공정성을 높이고, 결과에 대한 신뢰도와 수용성을 높이는 데 도움이 될 것"이라며 "앞으로도 의약품 허가·심사 제도를 합리적이고 효율적으로 운영하기 위해 최선을 다하겠다"고 밝혔다.
개정 안내서는 '식약처 대표 누리집(mfds.go.kr) → 법령/자료 → 공무원지침서/민원인안내서'에서 확인할 수 있다.
관련기사
- 40배 오른 의약품 심사료... 식약처 심사도 '돈값 할' 준비 중
- 품질평가+심사조정까지, 식약처 새 허가정책 베일 벗었다
- 식약처, 허가총괄·제품허가담당관 폐지…제품 중심 심사로
- 식약처 "GLP-1 비만치료제, 허가범위 내에서 신중히 사용해야"
- 정부 "수급불안정 의약품, 정의·기준 마련 후 사회적 합의"
- 식약처-지자체, 25일부터 의료제품 분야 기획합동감시
- 식약처 내년 예산 8122억원 편성...전년비 8.4% 증액
- 식약처, 'Click! 글로벌 바이오의약품 정보' 초성 퀴즈 이벤트
- 정부 "글로벌 임상 3위 도약" 선언…뒤처진 경쟁력 만회할까

