18일~22일까지 22개 품목허가 획득...임상시험계획은 30건 승인

식품의약품안전처는 지난주(8월18~22일) 총 22개 품목을 허가했다. 전문의약품 13개, 일반의약품 9개 품목이다. 이들은 궤양성 대장염, 크론병, 알츠하이머형 치매, 제2형당뇨병, 근위축성 측삭경화증 등 적응증으로 허가됐다.
존슨앤드존슨이 개발한 '트렘피어(성분 구셀쿠맙)'의 정맥주사(IV) 제형이 허가됨과 동시에 타 제형의 기존 출시 품목들이 궤양성 대장염 및 크론병 적응증이 추가됐다.
트렘피어는 염증 유발과 연관된 인터루킨-23(IL)을 억제하는 생물학적 제제로, IL-23 내 소단위인 p19를 타깃하는 항체 의약품이다.
한국얀센은 지난 21일 트렘피어정맥주사를 식약처로부터 허가받았다. 보편적인 치료제, 생물학적 제제 또는 소분자약제 등에 적절히 반응하지 않거나, 반응이 없어지거나, 내약성이 없는 중증도~중증 성인 활성 궤양성 대장염 또는 크론병 환자에게 사용할 수 있다.
이와 함께 기존 국내 출시돼 있던 트렘피어 프리필드시린지(2018년 4월 12일 허가) 및 오토인젝터(2021년 5월 24일 허가) 제형도 △판상 건선 △손발바닥 농포증 △건선성 관절염 등에 이어 궤양성 대장염 및 크론병 적응증을 획득하게 됐다.
허가 사항에 따르면, 트렘피어 IV는 이들 환자의 유도요법(0, 4, 8주차)을 위해 사용되며, 프리필드시린지 및 오토인젝터 제형은 이후 유지요법(16주차부터 8주마다)에 사용된다. 만약 투여 중 충분한 치료 효과를 보이지 않는 경우, 12주 및 이후 매4주마다 투여하는 것을 고려할 수 있다.
한편, 현재 국내에 허가된 IL 계열 궤양성 대장염 치료제는 스텔라라(성분 우스테키누맙)와 옴보(성분 미리키주맙) 뿐이다. 다만 한국릴리가 옴보의 국내 출시 계획을 반려함에 따라, 궤양성 대장염 치료제로 사용되는 IL 계열 치료제는 스텔라라가 유일하다.
이 외에도 트렘피어와 동일한 IL-23을 타깃하는 애브비의 스카이리치도 궤양성 대장염 및 크론병 적응증을 획득하기 위한 3상(소아청소년) 및 3b(성인) 임상시험계획을 지난달 17일 승인받았다.
특히, 스카이리치는 작년 6월 미국 식품의약국(FDA)에서 성인 중증도·중증 활동성 궤양성 대장염 치료제로 적응증 획득한 상황이다. 이에 내년 상반기 국내에서 동일 적응증을 획득할 것으로 예상되며, 향후 트렘피어, 스카이리치의 건강보험 급여등재 속도가 궤양성 대장염 및 크론병 시장 경쟁의 중요한 열쇠가 될 것으로 전망된다.
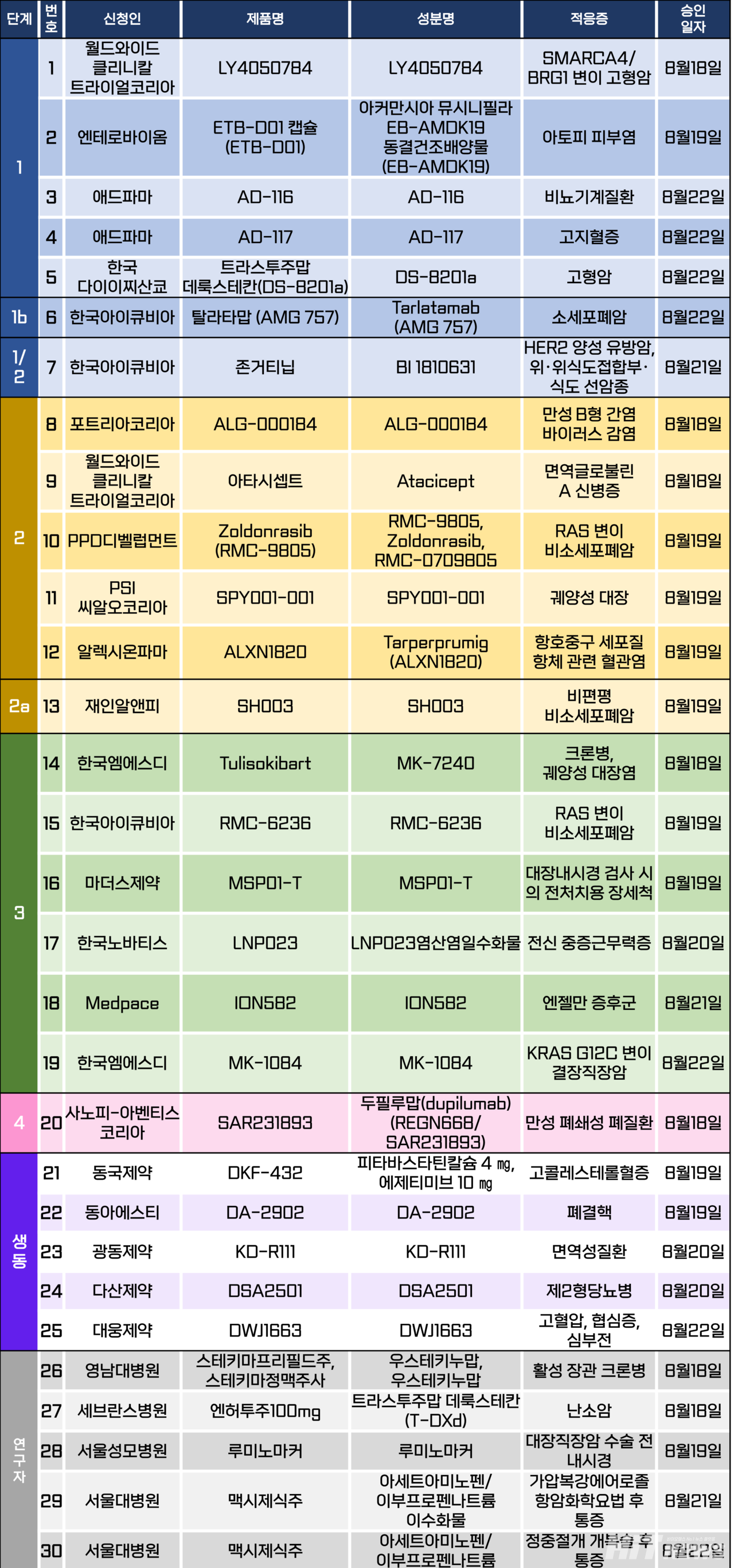
임상시험계획은 총 30건이 승인됐다. 세부적으로 △1상 5건 △1b상 1건 1/2상 1건 △1/2a상 1건 △2상 5건 △2a상 1건 △3상 6건 △4상 1건 △생물학적 동등성 5건 △연구자 임상 5건 등이다. 이 임상 시험들은 만성 B형 간염 바이러스 감염, 면역글로불린 A형 신병증, 크론병, 궤양성 대장염, 전신 중증근무력증, 엔젤만 증후군 등 질환, RAS 변이 비소세포폐암, KRAS G12C 변이 결장직장암 등을 대상으로 승인됐다.
재인알앤피가 개발 중인 천연물 항암제 신약 후보물질 'SH003'이 2a상 임상시험에 돌입한다.
회사는 지난 19일 면역항암제 치료를 받은 적 있는 비편평 비소세포폐암 환자를 대상으로 SH003+Docetaxel 병용요법의 안전성 및 유효성을 확인하기 위한 2a상 임상시험계획을 승인받았다.
이번 임상시험은 오는 2028년 8월까지 69명의 국내 환자 참여를 목표로 △고려대 의대부속 구로병원 △경희대병원 △화순전남대병원 등 의료기관에서 진행될 예정이다. 환자들은 SH003을 1일 3회 경구 복용한다.
연구진은 1차 유효성평가변수로 무진행 생존기간(PFS)을, 주요 2차 유효성평가변수를 △객관적 반응율(ORR) △전체생존기간(OS) △질병조절율(DCR) 등으로 설정했다.
SH003은 경희대 한의대 교수로 재직 중이었던 고성규 재인알앤피 대표가 한방에서 항암 효능이 검증된 '당귀보혈탕'을 기반으로 황기, 과루근 등을 새롭게 조합해 개발하고 있는 천연물 항암신약 후보물질이다.
이 물질은 암세포의 비정상적인 STAT3 인산화 경로 및 전사 활성을 억제함으로써, 암을 유발할 수 있는 Cyclin D1, 인터루킨-6(IL-6) 등의 유전자 발현을 감소시킨다. 핵심 종양 유전자로 분류되는 EGFR의 활성화를 억제하고, 다약제 내성을 유도하는 MDR1 저해해 내성 요인을 차단한다.
회사는 2017년 설립 시점 부터 SH003의 연구를 주도해 왔으며, 2024년부터는 경희대 선도연구센터 한약물 재해석 암 연구 센터(MRC)와 광동제약 천연물융합 연구개발본부와 SH003 개발을 위한 협약을 맺고 공동 연구를 진행 중에 있다.
현재 SH003을 면역항암제의 대상이 되지 않는 비소세포폐암을 주 적응증으로, 유방암, 위암, 췌장암, 전립선암, 자궁경부암 등을 고려해 개발 중이며, 표적치료제나 면역항암제와의 병용투여도 고려중인 것으로 나타났다.
또한, 지난 2023년 히트뉴스와의 인터뷰에서 국내 2상 임상 종료 시점에 맞춰 미국 FDA 2상 진입을 준비하고, 그 결과를 바탕으로 2026년에는 규제기관으로부터 조건부허가를 받겠다는 중장기 성장 전략을 밝힌 바 있다.

