방혜림 기자의 약물 큐레이션(Curation)
150㎎ 투여 환자 97% 8주 이내 완전 관해 달성
국내 환자 14명·대체 약제 부재로 경평 유예 대상
유전성 재발열 증후군 치료제 '일라리스(성분 카나키누맙)'가 세 번째 도전 끝에 급여 등재에 성공했다. 연간 청구액을 미리 정해 지출액을 초과할 경우 제약사가 건강보험공단에 환급하는 '총액 제한형'과 환자별 1년 단위로 관찰자료 및 연구결과를 제출해야 하는 사후관리 조건을 붙이고서다. 적용 시점은 내달 1일부터이며, 상한금액은 1102만9769원이다.
일라리스가 가진 적응증인 유전성 재발열 증후군은 전신에 이유 없는 발열, 발진 등이 주기적으로 반복되는 희귀 자가 염증성 질환인 크리오피린 관련 주기적 증후군(CAPS), 종양괴사인자 수용체 관련 주기적 증후군(TRAPS), 가족성 지중해열(FMF)을 한데 묶어 총칭하는 질환이다.
일라리스 급여적용되는 유전성 재발열 증후군은?
CAPS는 1번 염색체에 있는 NLRP3 유전자 변이에 의해 변형된 유전자 생산물 Cryoptrin이 IL-1β의 과잉 생산을 일으켜 전신 염증 반응이 나타나는 질환으로, 중증도에 따라 △가족성 한냉 자가염증성 증후군(FCAS) △머클-웰스 증후군(MWS) △신생아 발현 다발성 염증 질환(NOMID)/만성 영아 신경 피부 관절 증후군(CINCA) 등 3가지로 나뉜다.
주요 질환은 발열, 관절통, 결막염 등의 염증성 발작(flare)이 있으며, 가장 중증의 유형인 NOMID/CINCA는 뼈와 관절 기형으로 인한 저신장증과 만성 무균성 뇌막염으로 인한 중추신경계(CNS) 이상으로, △만성 두통 △간질 △뇌졸중 △인지 장애 등을 유발한다.
TRAPS는 12번 염색체에 있는 TNFRSF1A 유전자의 돌연변이로 인해 발생하며, 대표적인 증상은 △주기적 발열 △복통 △발진 △늑막 통증 등이 일주일 이상 지속된다.
FMF는 16번 염색체에 있는 MEFV 유전자의 이상으로 발생하는 질환이다. 주요 증상은 flare의 48-96시간 지속, 심한 통증 등이 있으며 적절한 치료를 받지 못한 환자 60%에서 아밀로이드증이 발생하는데, 이로 인해 말기신부전이 발현될 수 있다.
현재 CAPS와 TRAPS의 치료법으로는 IL-1 억제제가 우선 권고되며, 증상 완화를 위한 보조요법으로 MSAIDs 또는 코르티코스테로이드가 쓰인다. FMF는 colchicine이 우선 사용되며, 2차 치료제로 △IL-1 억제제 △TNF-α 억제제 △IL-6 억제제가 권고된다.
일라리스 임상결과는?
노바티스에 따르면 일라리스는 IL-1 억제제이자 미국·유럽 등에서 유일하게 허가된 CAPS 치료제다. 임상 연구 결과, 일라리스 150㎎을 투여한 CAPS 환자의 97%는 오픈라벨 기간 동안 1회 투여로 8주 이내 완전 관해를 달성했다.
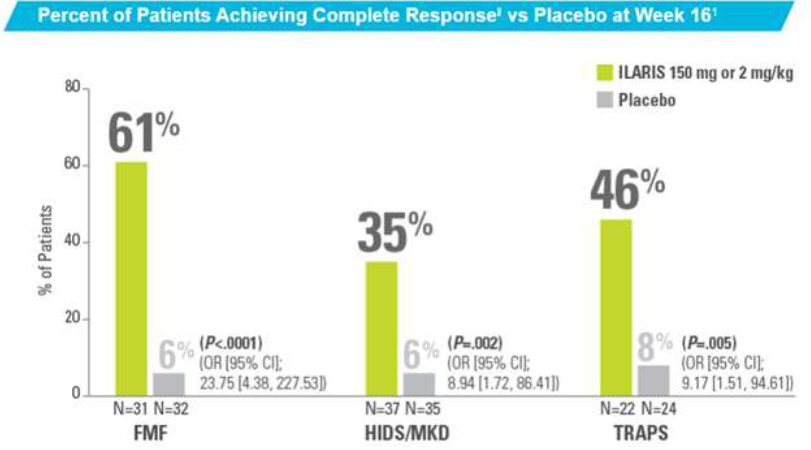
또 TRAPS 환자 46명, crFMF 환자 63명을 대상으로 진행된 임상 3상 연구에서 치료 16주 차에 위약군 대비 높은 완전 반응률을 보이며, 유의미한 결과를 나타냈다.
일라리스는 지난 2월과 4월에 열린 약제급여평가위원회에서 비용효과성이 불분명해 '추후 제약사의 자료 제출'이 필요하다는 평가를 받았다. 다만, CAPS가 2020년 기준 국내 환자 수가 적은 희귀질환이라는 점과 동일 적응증의 대체 약제가 없다는 점 등을 고려해 경제성평가 유예 약제로 급여 목록에 이름을 올렸다.
따라서 노바티스는 환자별 관찰 기간 2년, 1년 단위로 관찰 자료 및 연구 결과를 제출하고, 위험분담 계약기간 만료 평가 시 CAPS 중 신생아 발현 다발성 염증 질환(NOMID/CINCA) 적응증에 대해 임상적 유용성 및 비용효과성 자료를 제출해야 한다.
일라리스 세부 급여기준은
일라리스의 세부적인 급여기준은 △소아(만 2세 이상) 및 성인에서의 크리오피린 관련 주기적 증후군(CAPS)의 치료(FCAS/FCUㆍMWSㆍCINCA) △소아 및 성인에서의 종양괴사인자 수용체 관련 주기적 증후군(TRAPS)의 치료 △소아 및 성인에서 콜키신이 금기이거나, 내약성이 없거나, 또는 최고 내약 용량의 콜키신에서도 적절한 반응을 나타내지 않는 가족성 지중해 열(FMF)의 치료 필요시 콜키신과 병용 등이다.

