오테즐라 용도 특허 남아있음에도, 후발주자들 허가 움직임
쿄와기린, 신장암 치료제 '포티브다' 안과질환 점안제로 개발 중
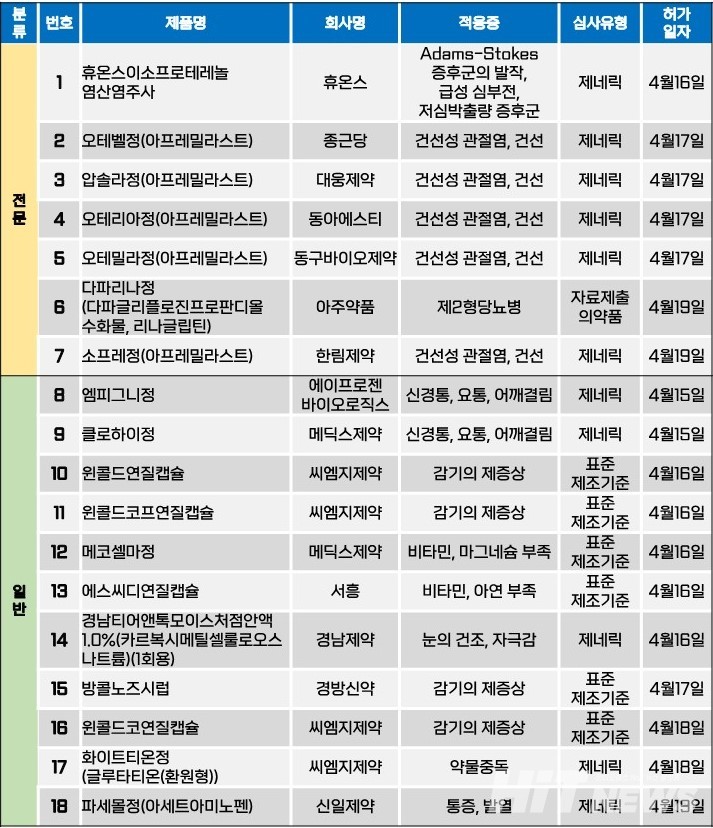
지난주(4월15일~19일) 총 18개 품목이 식품의약품안전처로부터 품목허가를 받았다. 전문의약품은 7개 품목, 일반의약품은 11개 품목이었다. 이들은 건선성 관절염, 건선, 제2형당뇨병, 급성 심부전 및 저심박출량 증후군 등 다양한 적응증으로 허가됐다.
한 주간 암젠이 개발한 경구용 건선치료제 ‘오테즐라(성분 아프레밀라스트)’의 제네릭 의약품 5품목이 허가됐다. 회사는 2017년 11월 오테즐라의 국내 허가를 받았지만, 이후 출시하지 못한 채 2022년 6월 자진 취하한 바 있다.
이번에 허가된 제네릭 의약품은 지난 17일 △종근당 '오테벨정' △대웅제약 '압솔라정' △동아에스티 '오테리아정' △동구바이오제약 '오테밀라정', 19일 △한림제약 '소프레정' 등 5개 품목이다.
현재 오테즐라는 품목이 취하된 상태지만, 관련 특허는 남아있어 후발주자들의 진입이 제한된 상황이었다. 관련 특허 3개 중, 용도 특허는 2023년 만료됐고, 제제 특허는 후발주자들이 소극적 권리 범위확인 심판에서 청구성립 심결을 받았다.
또, 지난 8월 대웅제약, 동아에스티, 종근당, 동구바이오제약, 마더스제약, 유유제약, 휴온스, 코스맥스파마 등이 제기한 '(+)-2-[1-(3-에톡시-4-메톡시페닐)-2-메틸설포닐에틸]-4-아세틸아미노이소인돌린-1,3-디온: 그것의 조성물 및 사용방법' 특허 무효심판에서 회사들은 일부기각 및 일부각하 심결을 받았다. 이 특허는 오는 2028년 3월 만료되는 오테즐라의 용도 특허다.
이에 업계에서는 특허 분쟁이 완료되지 않은 상황에서 후발주자들의 제네릭 허가 움직임은, 암젠 측이 국내 시장을 포기한 만큼 추후 불필요한 특허 침해 소송을 진행하지 않을 것이라고 판단한 것 아니냐고 분석하고 있다.
물론 제네릭 제품 출시 시점까지 이 상황을 속단하긴 어렵지만, 향후 오테즐라 특허 분쟁에 참여했던 제네릭 개발사들의 품목허가 움직임은 계속될 것으로 전망된다.
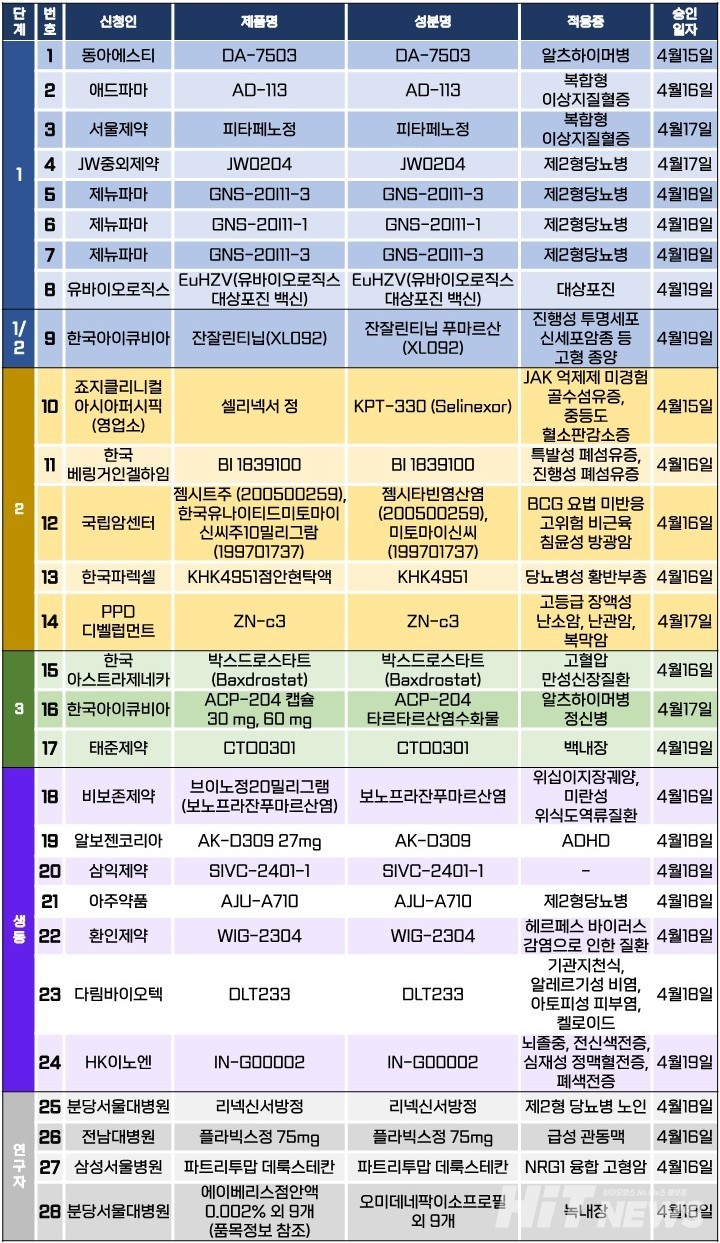
임상시험계획은 총 28건이 승인됐다. 세부적으로 △1상 8건 △1/2상 1건 △2상 5건 △3상 3건 △생물학적 동등성 7건 △연구자 임상 4건 등이다. 이 임상시험들은 제2형당뇨병, 이상지질혈증, 알츠하이머병, 대상포진, 골수섬유증, 당뇨병성 황반부종, 폐섬유증, 만성신장질환 등 질환과 방광암, 난소암, 난관암, 복막암 등 암종을 대상으로 승인됐다.
LG화학의 손자회사인 미국 아베오 온콜로지(AVEO Oncology)가 보유한 신장암 표적치료제 ‘포티브다(성분 티보자닙)’의 당뇨병성 황반부종(DME) 적응증 확대를 위한 국내 2상 임상시험이 시작된다.
티보자닙은 일본 쿄와기린이 개발해 2006년 아베오와 라이선스 계약을 진행한 바 있는 의약품으로, 개발권은 쿄와기린이 보유하고 있다. 현재 회사는 혈관내피성장인자(VEGF) 티로신 키나아제억제제(TKI)인 티보자닙 성분의 점안제(연구코드명 KHK4951)를 개발하고 있다.
이번에 승인된 2상 임상시험계획은 당뇨병성 황반부종 환자에서 혈관 내피 성장 인자 수용체 억제제인 'KHK4951'의 유효성 및 안전성을 평가하는 다기관, 무작위 배정, 이중 눈가림, 평행군 임상시험에 대한 내용이다.
연구는 내년 11월까지 국내 30명(글로벌 117명) 당뇨병성 황반부종 환자를 대상으로 △강남세브란스병원 △가톨릭대 의정부성모병원 등 의료기관에서 진행될 예정이다.
연구진은 일차유효성평가변수를 ‘제52주에 ETDRS(Early treatment of diabetic retinopathy study) 시력표로 측정된 BCVA(최대 교정 시력)의 제16주 대비 15자 이상 감소(reduction)’로 설정했다.
또, 이차유효성평가변수는 △제16주부터 첫 구제 IVT(유리체내) 주사까지의 시간 △임상시험 치료기 동안 구제 IVT 주사 횟수 △각 평가 시점에 ETDRS 시력표로 측정된 BCVA의 제16주 대비 변화 △각 평가 시점에 SD-OCT(스펙트럼 영역 광간섭 단층 촬영)로 측정된 CST (중심 영역 망막 두께)의 제16주 대비 변화 등이다.
한편, 쿄와기린이 승인받은 안과질환 대상 2상 임상시험은 이번이 처음이 아니다. 회사는 지난 2월 14일 신생혈관성 연령 관련 황반변성(nAMD) 환자를 대상으로 한 2상 임상시험계획을 승인 받아 현재 환자 모집을 진행 중에 있다.

