일라이릴리, IL-23 억제 기반 궤양성 대장염 치료제 '옴보' 허가
얀센, 피부 관련 이상반응 발생 환자 관리 강화 목적 임상 승인
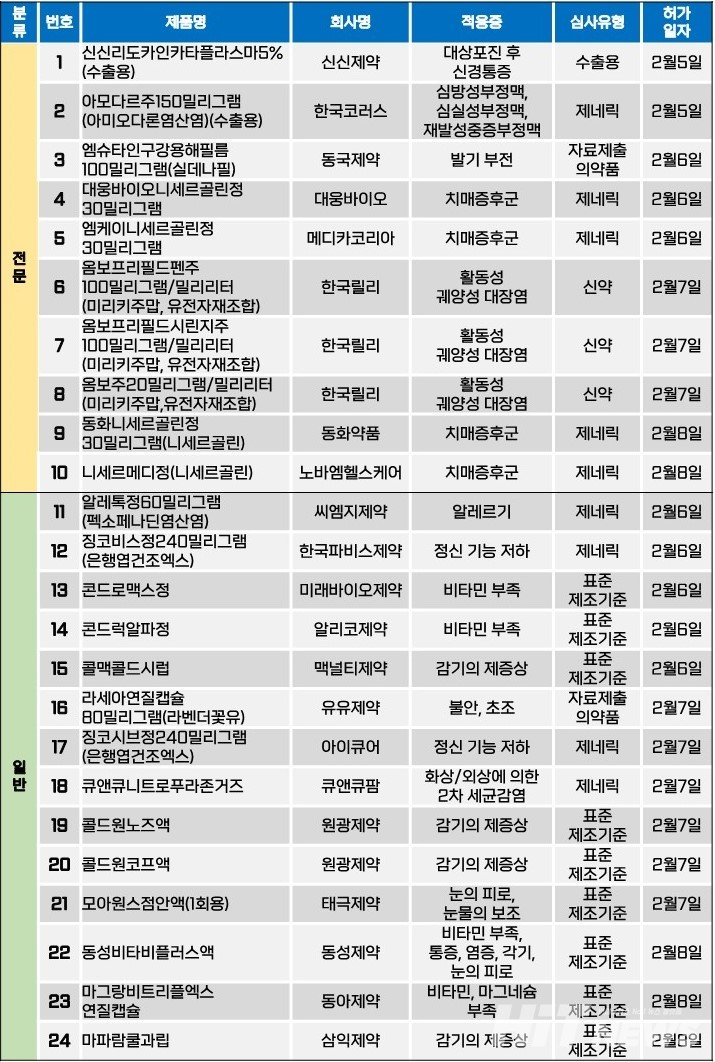
지난주(2월5~9일) 총 24개 품목이 식품의약품안전처로부터 품목허가를 받았다. 전문의약품은 10개 품목, 일반의약품은 14개 품목이었다. 이 의약품들은 대상포진 후 신경통증, 부정맥, 치매증후군, 활동성 궤양성 대장염 등 다양한 적응증으로 허가됐다.
일라이릴리가 개발한 인터루킨-23(IL-23) 억제 기반 궤양성 대장염 치료제 '옴보(성분 미리키주맙)'가 지난 7일 품목허가를 획득했다. 옴보는 궤양성 대장염과 관련된 염증에 작용하는 IL-23의 'p19 아단위(subunit)'를 선택적으로 타깃하는 표적치료제다.
회사 측에 따르면, 옴보는 염증성 질환을 유발하는 사이토카인의 공급원인 T세포 하위집단과 선천성 면역세포 하위집단의 분화, 확장 및 생존에 영향을 미치는 조절 사이토카인인 IL-23를 선택적으로 차단함으로써 사이토카인의 생산을 정상화시킨다. 옴보는 이번 허가를 통해 '코르티코스테로이드제 또는 면역억제제 등 또는 생물학적 제제에 적절히 반응하지 않거나, 반응이 소실되거나 또는 내약성이 없는 성인의 중등도에서 중증의 활동성 궤양성 대장염의 치료'를 목적으로 사용할 수 있게 됐다.
한국릴리는 옴보의 허가를 위해 'LUCENT-1', 'LUCENT-2' 등 2개의 3상 임상시험 데이터를 제출했다. 회사는 최대 12주간 옴보를 투여하는 정맥내 유도시험인 LUCENT-1을 진행했고, 이후 40주간 피하 무작위 중단 유지시험인 LUCENT-2를 실시하는 등 최소 52주(1년)간 치료 연구를 지속했다.
각 임상은 최소 3개월 간 궤양성 대장염을 겪은 것으로 진단되고, 질병 활성도 점수(Mayo score) 중 내시경 하위 점수가 2점 이상, 개정 질병 활성도 점수(modified Mayo score)가 4~9점으로 정의되는 중등도 내지 중증의 활동성 질환으로 진단된 환자를 대상으로 했다. 또 환자들은 이전에 코르티코스테로이드 또는 면역조절제(6-머캅토퓨린, 아자티오프린) 또는 한 가지 이상의 생물학적 제제(TNF-α 저해제 및/또는 베돌리주맙) 또는 토파시티닙 치료에 실패(반응 소실, 부적절한 반응, 또는 불내성)한 경험이 있었다.
LUCENT-1 연구 결과, 옴보 투여 환자군 중 24.2%가 12주차에 임상적 관해를 달성해, 위약 투여군(13.3%)보다 유의하게 높았다(p<0.001). 이러한 경향은 하위 그룹에서도 일관되게 나타났다. 아울러 옴보군은 2주차부터 위약 투여군 대비 직장 출혈 하위 점수 및 배변 빈도 하위 점수가 더 크게 감소했는데, 임상 반응이 나타난 환자는 옴보군 63.5%, 위약군 42.2%였다(p<0.001).
이어 LUCENT-2 연구 결과, 유지 기간(40주) 동안 옴보로 치료받은 환자의 49.9%가 임상적 관해를 달성해, 위약 투여군(25.1%)보다 유의하게 높았다(p<0.001). 또 LUCENT-1에서 임상적 관해를 나타낸 환자 중 LUCENT-2에서 옴보를 통한 치료를 이어간 환자의 63.6%가 임상적 관해를 유지한 반면, 위약 투여군은 36.9%만이 임상 관해가 유지됐다(p<0.001).
두 임상에서 가장 흔하게 보고된 이상반응은 상기도 감염(비인두염 포함), 두통, 발진, 주사 부위 반응 등이었다.
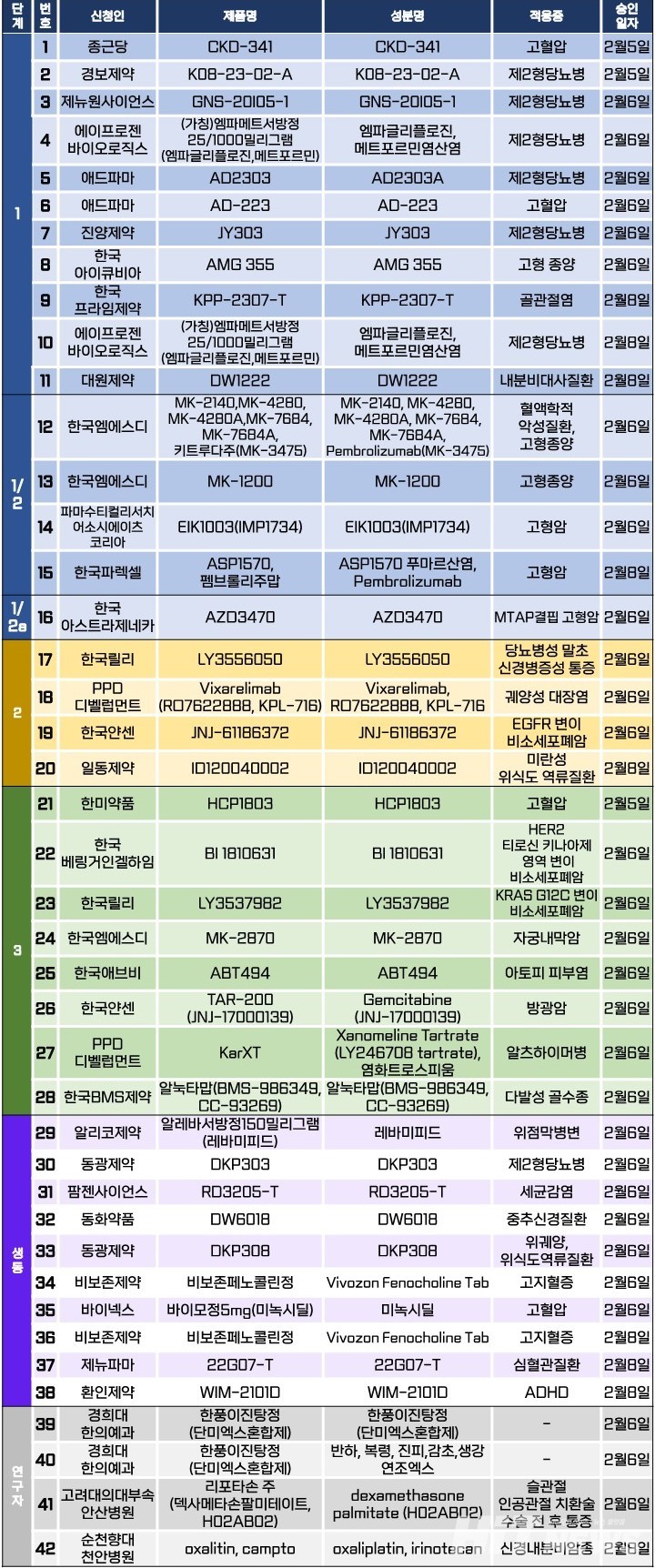
임상시험계획은 총 42건이 승인됐다. 세부적으로 △1상 11건 △1/2상 4건 △1/2a상 1건 △2상 4건 △3상 8건 △생물학적 동등성 10건 △연구자 임상 4건 등이다. 이 임상시험들은 고혈압, 제2형 당뇨병, 당뇨병성 말초 신경병증성 통증, 위식도 역류질환, 궤양성 대장염, 아토피 피부염, 알츠하이머병 등 질환과 자궁내막암, 방광암, 답라성 골수종, 비소세포폐암 등 암종을 대상으로 승인됐다.
한국얀센과 유한양행이 공동 개발 중인 '렉라자(성분 레이저티닙)'와 '리브리반트(성분 아미반타맙)' 병용요법을 진행한 환자 중 피부 관련 이상반응이 나타난 환자의 관리를 강화하기 위한 연구가 진행된다. 한국얀센은 지난 6일 '아미반타맙+레이저티닙 병용요법으로 1차 치료를 받고 있는 국소 진행성 또는 전이성 EGFR(표피성장인자수용체) 돌연변이 비소세포폐암 환자 중 선별된 피부 이상사례를 보인 환자에 대한 강화된 피부관리 대 표준 피부관리의 영향을 평가'하는 라벨 공개, 무작위 배정 2상 임상시험계획을 승인받았다.
렉라자는 현재 EGFR 변이 양성 비소세포폐암 환자의 1차 치료 및 EGFR T790M 변이 양성 환자의 2차 치료제로 허가 받은 항암제다. 또 리브리반트는 백금 기반 화학요법 치료 중 또는 치료 이후에 질병이 진행된 EGFR 엑손 20 삽입 변이가 있는 국소 진행성 또는 전이성 비소세포폐암 환자의 치료제로 허가돼 있다.
렉라자와 리브리반트 병용요법은 △발진(rash) △손발톱주위염(paronychia) △여드름양 피부염(dermatitis acneiform) 등이 3등급 이상 피부 관련 이상반응 중 가장 빈번했던 것으로 알려져 있어, 이를 관리하기 위한 추가 임상을 진행하려는 것으로 추측된다. 이번에 승인된 임상시험계획에 따르면, 임상시험은 총 10명의 국내 환자(글로벌 180명)를 대상으로 2026년 3월까지 완료하는 것을 목표로 한다. 연세대 의대 세브란스병원, 충북대병원, 가천대부속 길한방병원 등 의료기관에서 진행될 예정이다.
연구진은 이번 임상의 1차 유효성 평가변수(Primary endpoint)를 '항암 요법 개시 후 12주 동안 2등급 이상의 관심 대상 피부이상사례(DAEI)가 발생한 참가자 수'로 설정했다. 또 2차 유효성 평가변수(Secondary endpoint)로 △NCI CTCAE v5.0에 따른 중증도별 DAEI가 있는 참가자수, 항암 요법 개시 후 6개월 동안 2등급 이상 DAEI를 가진 참가자수, 중중도별 손발톱주위염의 참가자수, 중중도별 두피 발진의 참가자수 △베이스라인부터 12개월까지 Skindex 증상 영역 점수 변화, PGI-S 발진의 변화, EORTC-QLQ-C30 점수의 변화 △DAEI로 인한 항암 요법의 용량 감량, 일시 중지 및 중단 빈도를 경험한 참가자의 비율 △항암요법의 상대용량 강도(RDI) △무진행 생존기간(PFS) △객관적 반응률(ORR) △반응 기간(DoR) 등으로 설정했다.
한편, 렉라자와 리브리반트 병용요법을 연구한 핵심 3상 임상시험으로 '마리포사(Mariposa)'가 있다. 작년 10일 스페인 마드리드에서 진행된 유럽종양학회(ESMO)에서 주요 데이터가 소개된 바 있다.
당시 발표에 나선 조병철 연세암병원 폐암센터장은 "마리포사 연구는 렉라자와 리브리반트 병용요법을 통해 기존 1차 치료제인 '오시머티닙(제품명 타그리소)' 대비 무진행 생존기간(PFS)을 크게 향상시켰다"며 "미래에 이 치료요법이 새로운 기준 치료가 될 수 있는 가능성을 제시했다"고 발표한 바 있다.
조병철 교수에 따르면, 중앙 추적 기간 22개월 시점의 PFS(by BICR)는 렉라자+리브리반트 병용군이 23.7개월(95% CI : 19.1-27.7)로, 타그리소군의 16.6개월(95% CI : 14.8-18.5)보다 약 7.1개월의 개선을 보였다. 또 질병 진행 또는 사망 위험은 30% 감소한 것으로 분석됐다(HR=0.70, 95% CI = 0.58-0.85, P<0.001).
아울러 1차 치료 중단 이후 2차 치료의 무진행 생존기간으로 정의된 '2차 PFS'는 24개월 시점에서 병용군 74%, 타그리소군 64%로 나타났다. 이와 함께 22개월 기준 2차 치료에서의 질병 또는 사망 위험을 25% 감소시킨 것으로 나타났다(HR=0.75, 95% CI : 0.58-0.98, P=0.03).
다만, 병용군에서 이상반응(AE)은 더 많게 나타났다. 치료 후 발생된 이상반응(TEAE) 중 3등급 이상의 이상반응은 병용군에서 75%, 타그리소군에서 43%였다. 심각한(Serious) 이상반응은 각각 49%, 33%였다.
병용군에서 3등급 이상의 이상반응 중 빈번한 것은 △발진(rash) △손발톱주위염(paronychia) △여드름양 피부염(dermatitis acneiform) 등이었다. 간질성 폐질환ㆍ폐렴 발생은 2개군에서 각각 3% 미만으로 유사했다.

