유한양행, '애드파마' 3제 고혈압·고지혈증 치료제 2개 용량 추가 허가
알렉시온, AZ '스트렌식' 치료 경험 없는 저인산효소증 환자 대상 진행
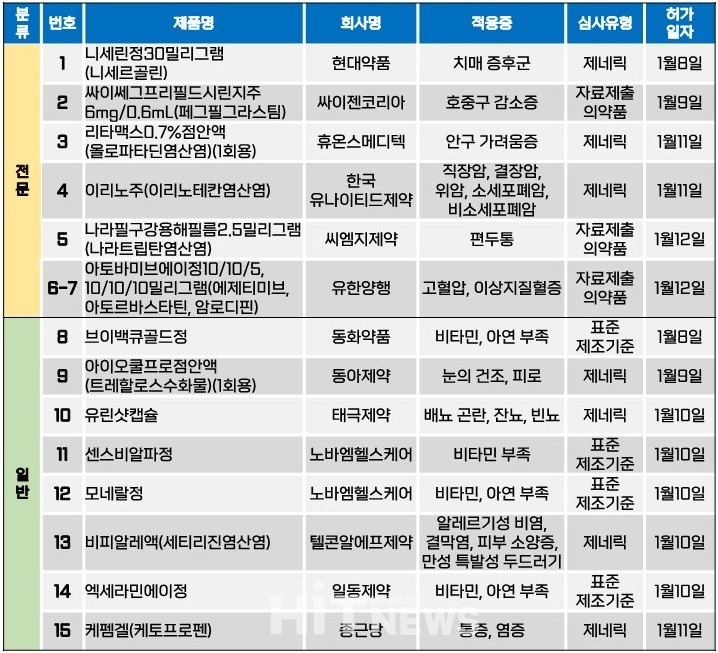
지난주(1월 8~12일) 총 15개 품목이 식품의약품안전처로부터 품목허가를 받았다. 전문의약품은 7개 품목, 일반의약품은 8개 품목이었다. 이 의약품들은 치매 증후군, 호증구 감소증, 직ㆍ결장암, 편두통, 고혈압, 이상지질혈증 등 다양한 적응증으로 허가됐다.
애드파마가 작년 5월 31일 허가 받았던 새로운 조합의 3제 고혈압ㆍ고지혈증 치료제의 새 용량 제품을 모회사인 유한양행이 지난 12일 허가받았다. '아토바미브에이정'은 고지혈증 치료제로 사용되는 아토르바스타틴과 에제티미브에 고혈압 치료 성분 암로디핀으로 구성된 3제 복합제로, 에제티미브+아토르바스타틴 복합제를 동시에 투여해야 하는 환자에 한정해서 사용할 수 있다. 기존 애드파마가 허가받은 △10/20/5(에제티미브/아토르바스타틴/암로디핀)㎎ △10/20/10㎎ △10/40/10㎎ 등 3개 용량 외에, 유한양행은 △10/10/5㎎ △10/10/10㎎ 용량을 허가받았다. 5개 제품 모두 유한양행이 제조를 맡는다.
유한양행이 5개 용량군에 대한 허가를 모두 마침에 따라, 본격적으로 3제 고혈압ㆍ고지혈증 시장에 뛰어들 것으로 전망된다. 기존에 허가된 3제 고혈압ㆍ고지혈증 복합제들은 △스타틴(콜레스테롤 합성 저해제)+사르탄(ARBㆍ안지오텐신Ⅱ 수용체 차단제)+암로디핀(CCBㆍ칼슘채널차단제) △스타틴+사르탄+에제티미브(콜레스테롤 흡수 저해제) 등으로 구성돼 왔다.
현재까지 허가된 3제 고혈압ㆍ고지혈증 복합제 조합별 대표 품목으로는 △보령의 '듀카로(로수바스타틴+피마사르탄+암로디핀)' △한미약품의 '아모잘탄큐(로수바스타틴+로사르탄+암로디핀)' △일동제약의 '텔로스톱플러스(로수바스타틴+텔미사르탄+암로디핀)' △HK이노엔의 '엑스원알(로수바스타틴+발사르탄+암로디핀)' △GC녹십자의 '로제텔(로수바스타틴+로사르탄+에제티미브)' △유한양행의 '듀오웰플러스(로수바스타틴+텔미사르탄+에제티미브)' △종근당의 '칸타벨에이(아토르바스타틴+칸데사르탄+암로디핀)' 등이 있다.
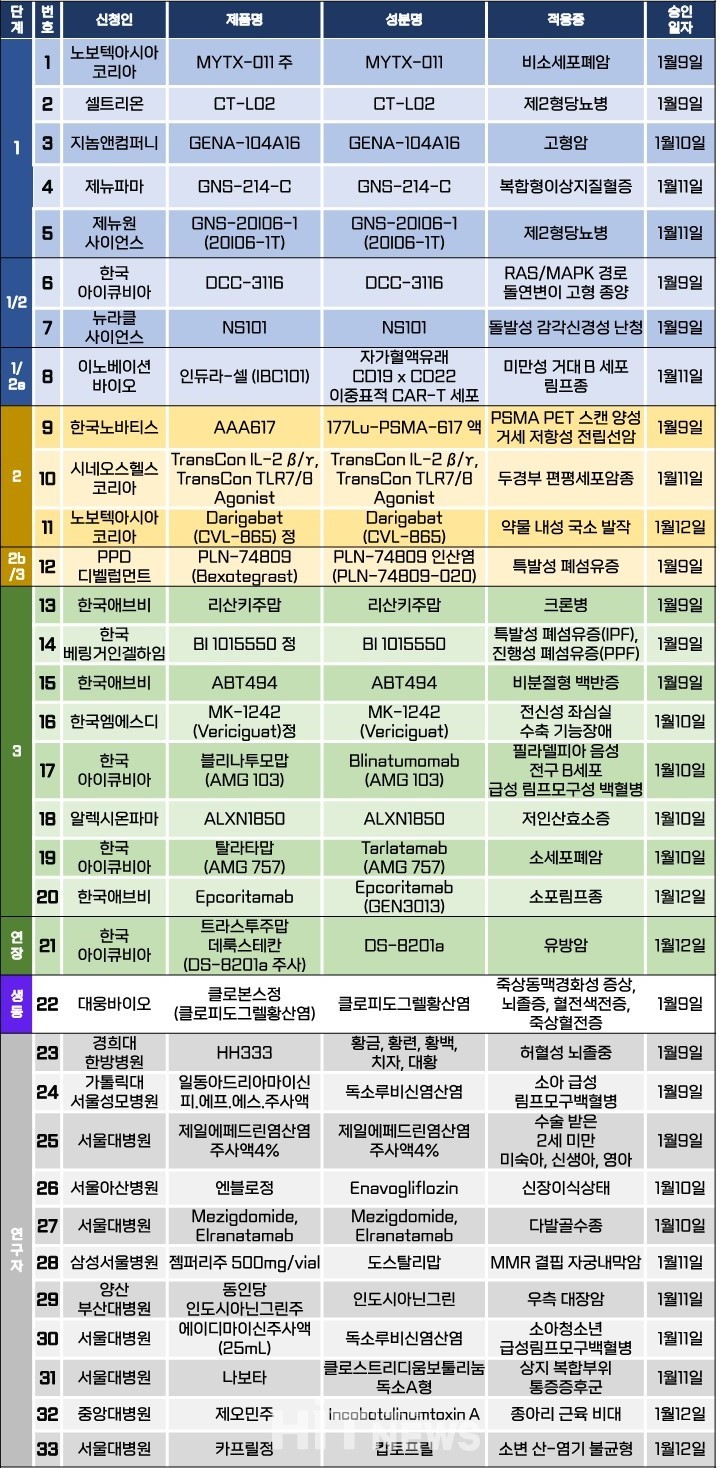
지난주 임상시험계획은 총 33건이 승인됐다. 세부적으로 △1상 5건 △1/2상 2건 △1/2a상 1건 △2상 3건 △2b/3상 1건 △3상 8건 △연장 1건 △생물학적동등성 1건 △연구자 임상 11건 등이다. 이 임상시험들은 제2형 당뇨병, 고혈압, 이상지질혈증, 돌발성 감각신경성 난청, 특발성 폐섬유증, 크론병, 저인산효소종 등 질환과 비소세포폐암, 소포림프종, 미만성 거대 B세포 림프종, 전립선암, 두경부암, 유방암 등 암종을 대상으로 승인됐다.
알렉시온파마는 현재 개발 중인 저인산효소증 치료제 'ALXN 1850(개발코드명)'의 3상 임상시험계획을 식품의약품안전처로부터 지난 10일 승인받았다. 저인산효소증은 근육 대사와 뼈 형성 과정에 필수적인 효소인 알칼리성 인산분해효소(ALP) 활성 감소로 발생하는 골격계 대사성 질환 중 하나다. 10만명당 1명 꼴로 발생하는 희귀질환으로, 혈액 중 칼슘이 뼈세포 사이 침착하는 '석회화'에 문제가 생겨 구루병을 야기할 수도 있다. 중증의 경우 출생 후 수일 내로 심각한 호흡부전으로 사망하거나, 성인 시점에서 골연화 증상이 나타날 수 있다.
이번 ALXN 1850의 3상 임상은 '이전에 아스포타제 알파(오리지널 스트렌식주)로 치료받은 적이 없는 청소년 및 성인 저인산효소증' 환자를 대상으로 피하 투여된 ALXN 1850(재조합 알칼리성 인산분해효소)의 유효성 및 안전성을 평가하기 위한 무작위 배정, 이중 눈가림, 위약 대조, 다기관 연구다. 이번 연구는 글로벌 114명(국내 4명)의 환자를 목표로, 2027년 8월까지 연세대 세브란스병원, 아주대병원, 서울 보라매병원 등 의료기관에서 진행될 예정이다.
연구진은 1차 유효성 평가변수로 △무작위 배정 평가 기간 종료(제169일) 시점 6MWT(6분 걷기시험)의 베이스라인 대비 변화로 설정했다. 2차 유효성 평가변수로 무작위 배정 평가 기간 종료(제169일) 시점의 △RSS(구루병 중증도 점수) △LEFS(하지기능척도) △TUG(일어서서 걷기 검사) △% 예측 6MWT 등으로 설정했다.
한편 희귀난치성 질환 치료제를 주력으로 개발하고 있는 알렉시온파마는 글로벌 제약사 '아스트라제네카'에 인수된 바 있다. 회사가 개발한 대표 희귀질환 신약으로는 △발작성 야간 혈색소뇨증(PNH) △비정형 용혈성 요독 증후군(aHUS) 치료제 '솔리리스(성분 에쿨리주맙)'가 있다. 고가 약제를 대상으로 시행되고 있는 '약제 사전심의 제도'가 2012년 이 의약품을 대상으로 도입된 바 있다.
이번 임상은 아스트라제네카가 보유하고 있는 저인산효소증 치료제 '스트렌식주'를 사용한 적 없는 청소년 및 성인 환자를 대상으로, 치료를 진행할 수 있도록 설계됐다. 스트렌식주는 현재 소아기(주산기ㆍ영아기ㆍ청소년기 포함)에 발병한 저인산효소증 환자의 골 증상을 치료하기 위한 장기간의 효소대체 요법으로 지난 2016년 2월 허가돼 사용되고 있다.

