리나글립틴+메트포르민 조합 서방정 '트라리틴콤비서방정' 국내 최초
아니프롤루맙 3상, 의료기관 또는 자택서 환자 PFS 투약 가능
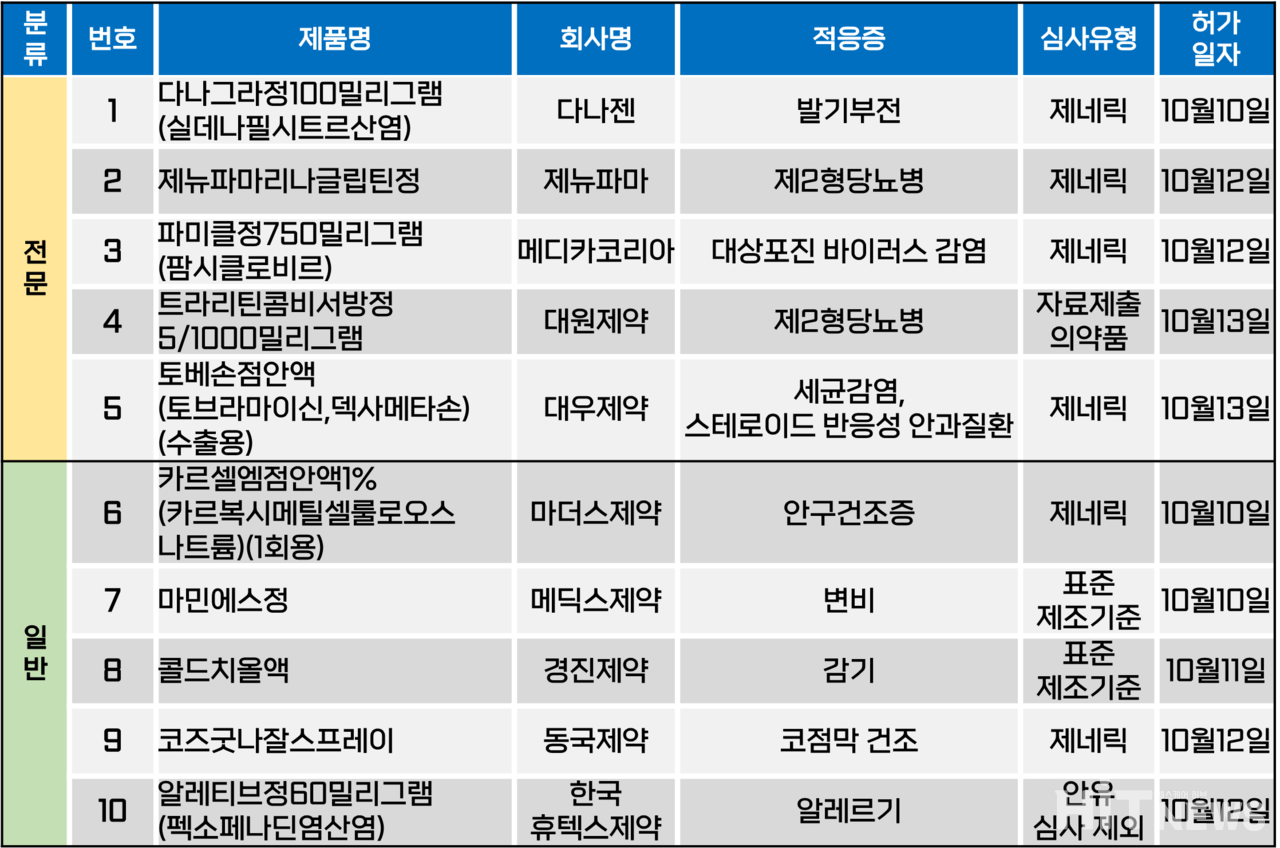
지난주(10월 9~13일) 총 10개 품목이 식품의약품안전처로부터 품목 허가를 받았다. 전문의약품 5개 품목, 일반의약품 5개 품목이었다. 이 의약품들은 발기부전, 제2형 당뇨병, 대상포진 바이러스 및 세균 감염 등 다양한 적응증으로 허가됐다.
대원제약이 개발한 제2형 당뇨병 서방형 복합제 '트라리틴콤비서방정(성분 리나글립틴+메트포르민염산염 콜로이드성이산화규소)'가 지난 13일 허가됐다. 허가 용량은 5/1000㎎(리나글립틴/메트포르민) 1개 품목이다.
이 품목은 기존 회사가 보유하고 있던 '트라리틴콤비정(성분 리나글립틴+메트포르민염산염)'의 염 및 제형 변경 제품이다. 트라리틴콤비서방정에는 콜로이드성이산화규소가 첨가제로 함유됐다.
기존 시타글립틴, 테네리글립틴, 알로글립틴, 제미글립틴 등 DPP-4 억제제 계열 성분과 메트포르민 성분의 서방형 복합제가 없었던 것은 아니지만, 리나글립틴과 메트포르민을 조합으로 한 서방정은 트라리틴콤비서방정이 최초다. 대원제약은 이번 허가로 회사는 △트라리틴(리나글립틴) △트라리틴콤비정 2.5/500㎎, 2.5/850㎎, 2.5/1000㎎ △트라리틴콤비정 5/1000㎎ 등 총 4개의 리나글립틴 성분 품목군을 확보하게 됐다.
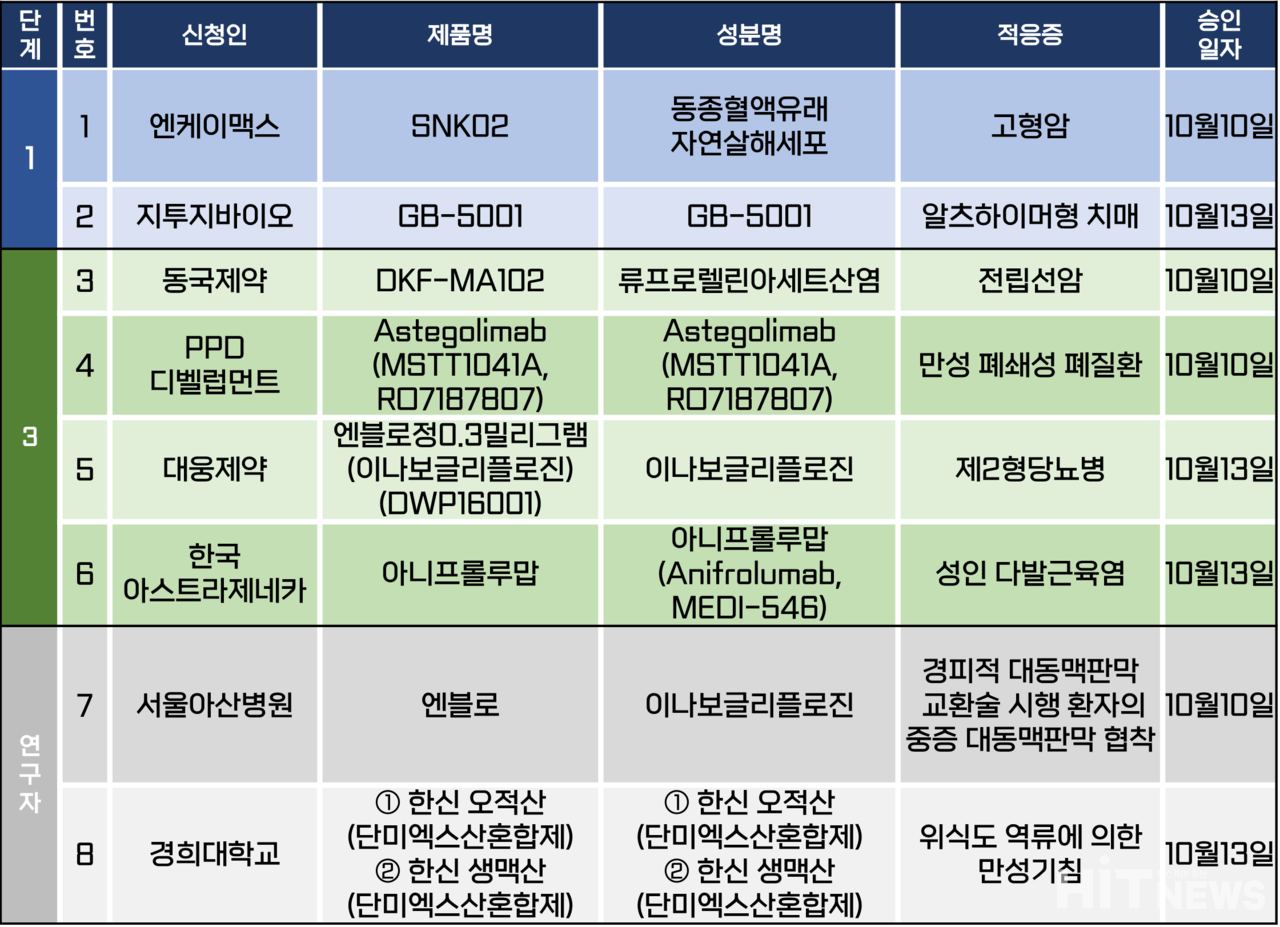
임상시험계획은 총 8건이 승인됐다. 세부적으로 △1상 2건 △3상 4건 △연구자 임상 2건 등이다. 이 임상시험들은 알츠하이머형 치매, 만성 폐쇄성 폐질환, 제2형 당뇨병, 성인 다발근육염, 전립선암 등 질환을 대상으로 승인됐다.
아스트라제네카가 개발하고 있는 1형 인터페론 수용체 항체 '아니프롤루맙(anifrolumab)'이 성인 다발근육염 환자를 대상으로 한 3상 임상시험계획이 지난 13일 승인됐다. 한국아스트라제네카는 이미 국내에서 아니프롤루맙의 활동성 전신 루푸스, 남녀 전신경화증 환자를 대상으로 한 임상 3상을 진행 중이다.
이번 임상은 성인 다발근육염 시험대상자를 대상으로 표준치료에 더해 아니프롤루맙을 피하주사로 투여한 뒤 표준치료+위약 대비 유효성과 안전성을 비교하기 위한 △다기관 △평행군 △이중 눈가림 △두 치료군 연구다.
연구진은 이번 임상의 1차 유효성 평가변수(Primary endpoint)로 ‘무작위배정 층화 인자에 따라 층화된 Cochran-Mantel-Haenszel(CMH)법을 활용해 반응에 도달한 시험대상자의 비율’로 설정했다.
임상은 △가톨릭대 서울성모병원 △서울대병원 △경희대병원 △충남대병원 등 시험기관에서 진행되며, 국내 대상 환자는 5명(글로벌 162명)이다. 임상 목표 완료 기간은 2027년 2월이다.
이번 임상은 환자가 시험기관 혹은 자택에서 PFS(프리필드시린지)를 통해 투여할 수 있게 했다는 특징이 있다. 이에 따라 환자는 시험기관의 직원 또는 본인이나 그 간병에 의해 아니프롤루맙을 투여받거나, 투여할 수 있다.
각 시험대상자마자 임상시험의 총 기간은 약 70주이며, 그 중 치료 기간은 최대 52주다. 스크리닝 방문과 안전성 추적조사 방문을 포함해 총 18회의 임상시험 방문이 계획됐으며, 대부분의 방문은 치료 기간 동안 매주 4주마다 실시될 예정이다.

