임상 승인받은 3년 만... 그 때와 달리 경증 환자 거의 없어

네오이뮨텍(대표 양세환)은 NIT-116(코로나19 바이러스 감염증)에 대한 임상 1상을 중단했다고 10일 공시했다.
NIT-116 임상은 코로나19 바이러스 감염증에 대한 지속성 재조합 IL-7(NT-I7)의 이중맹검, 무작위, 위약 대조, 임상 1상, 단일 용량, 용량 증량 시험 방식을 기반으로 했다.
NIT-116 임상 1상은 총 27명의 환자를 대상으로 진행하는 임상이었다. 회사는 임상 기간의 최초 목표를 24개월로 설정했다. 네오이뮨텍은 지난 2020년 6월 미국 식품의약국(FDA)서 1상 임상시험계획(IN)을 승인받았으며, 임상시험기관은 미국 국립 알레르기·전염병 연구소(NIAID) 및 미국 국립보건원(NIH)이었다.
회사 측에 따르면, NIT-116의 임상 1상은 코로나19 확진 판정을 받은 성인 환자(19세 이상 75세 이하) 중 경증 환자를 대상으로 용량 증량을 통한 시험약 및 위약 단회 투여의 안전성 및 예비효과를 탐색하고자 하는 이중맹검, 무작위, 위약 대조 방식에 중점을 뒀다.
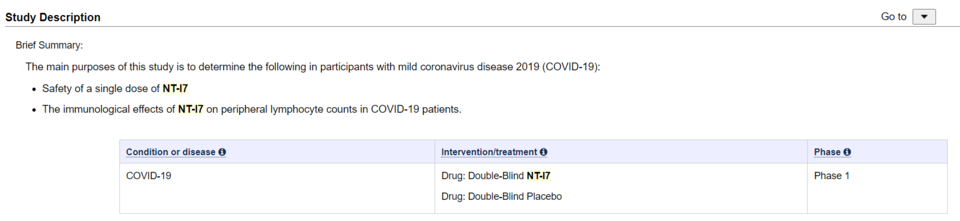
회사 관계자는 "임상시험 대상자에 대한 적합성을 확인한 후 시험군 또는 대조군에 1:1 무작위로 배정(이중맹검)돼 투여하는 방식이었다"며 "시험약과 위약은 첫 번째 용량인 60μg/kg(근육 투여)에서는 총 7명의 환자를 모집한 후 다음 용량인 120μg/kg, 360μg/kg(근육 투여)에서 총 10명을 투여하는 임상 프로토콜이었다"고 전했다.
그러나 회사는 임상 승인을 받은 지 3년 만에 자진 중단하기로 결정했다. 이 관계자는 "임상시험 대상 지역인 미국서 처음 연구를 기획했던 2020년 상황과 달리 임상 대상자인 코로나19 바이러스 확진 판정을 받은 성인 환자의 수가 평균 3만3126명(6일 기준)에 불과하다. 특히 입원 환자 수는 더 적다"고 말했다.
그는 "백신이 보편화되면서 이번 연구의 대상인 경증 환자는 거의 없고, 일반 독감과 구분이 되지 않아 대다수의 사람들이 병원을 방문하지 않고 있다"며 "현재 환자 모집이 거의 불가능한 상황"이라고 덧붙였다.
회사는 코로나19 관련 임상개발을 중단함에 따라 향후 키트루다 병용 재발 교모세포종(GBM) 임상 2상(NIT-120)에 집중할 전망이다. 지난달 임상 2상(NIT-120)서 첫 환자에게 NT-I7(물질명 efineptakin alfa) 투여를 완료한 바 있다.

