(2019.09.03~09.14.) 식약처, 최근 2주간 26건 승인

추석 연휴로 인해 최근 2주간 임상시험 승인 건수는 소폭 하락했다. 이런 가운데 개량신약과 항암제 · 희귀질환 치료제 임상이 눈길이 끌었다.
개량신약 전문 개발사로 알려진 유한양행 자회사 애드파마는 고지혈증과 고혈압 복합제 개발 임상에 들어간다. 얀센은 TNF-a 억제제인 '트렘피어'를 궤양성 대장염 치료에도 쓸 수 있도록 적응증 확대하는 임상시험을, 바이엘과 로슈는 국소 진행형 또는 전이성 고형암 개발 임상시험을 각각 진행한다.
15일 식품의약품안전처 의약품안전나라(구, 의약품통합정보시스템)에 따르면 지난 3일부터 14일까지 총 26건의 임상시험이 새로 승인받았다.
신청인(중복 포함)별로는 제약·바이오기업 20건, CRO 3건, 의료기관 3건 등으로 분포했다. 제약·바이오기업의 경우 국내사 14건, 다국적사 6건이었다. 시험단계별로는 ▶ 생동성 시험 11건 ▶ 3상 4건 ▶ 1상 3건 ▶ 2/3상 · 2b상 각 2건 ▶ 2상 · 연구자 임상시험 · 연장 각 1건으로 뒤를 이었다.

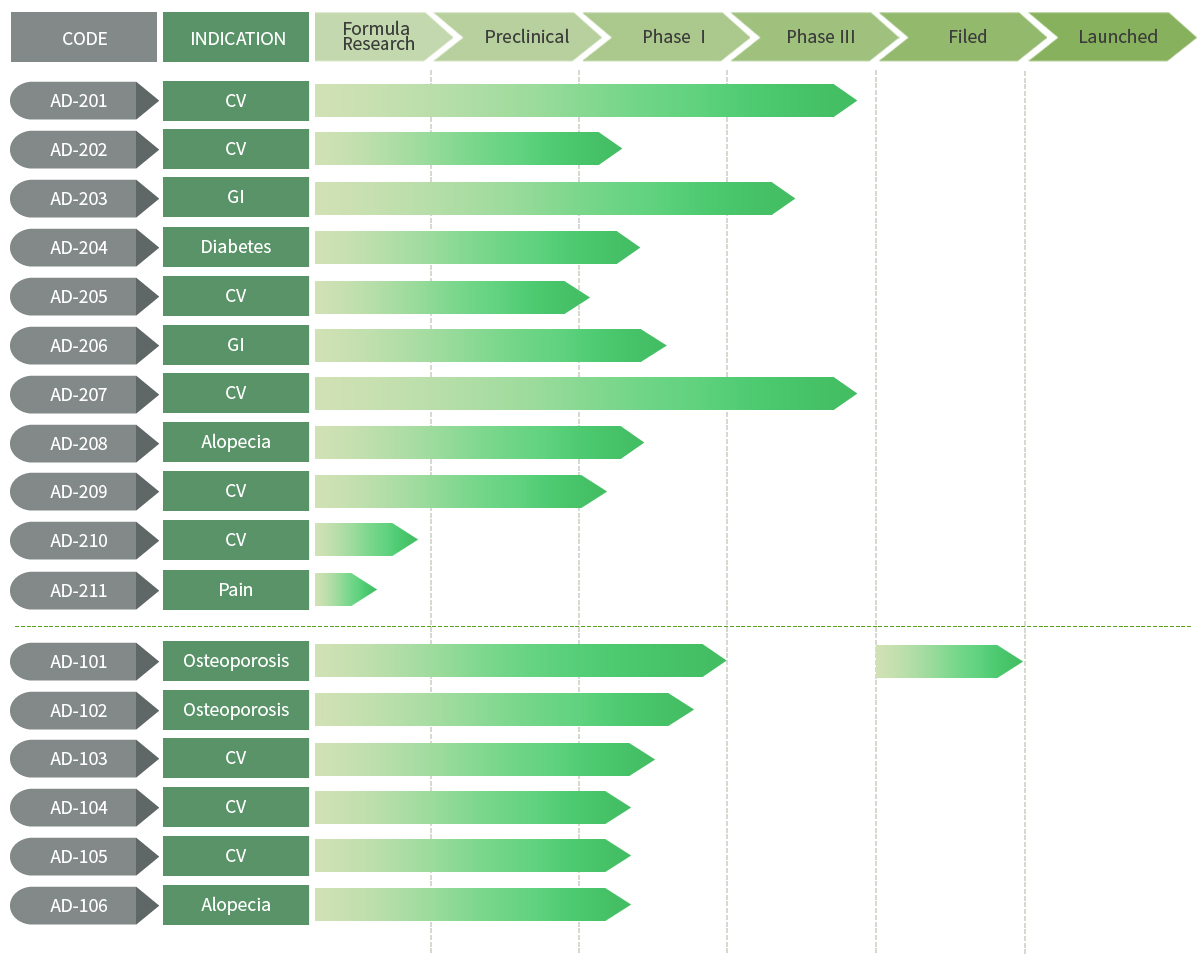
애드파마는 후보물질 'AD-207'의 임상 3상을 진행한다. '원발성 고콜레스테롤혈증 및 본태성 고혈압' 동반 환자를 대상으로 AD-207의 유효성·안전성을 평가하기 위한 3상 임상이다.
앞서 애드파마는 지난해 8월 건강한 성인 남성에서 AD-2071과 AD-2072 병용 투여 시 약물상호작용을 평가하는 임상 1상을, 올 초에는 건강한 성인 대상 AD-2071 및 AD-2072 병용 투여와 AD-207 복합제 투여 시 약동학적 특성과 안전성/내약성을 평가하는 1상시험을 각각 실시했었다.
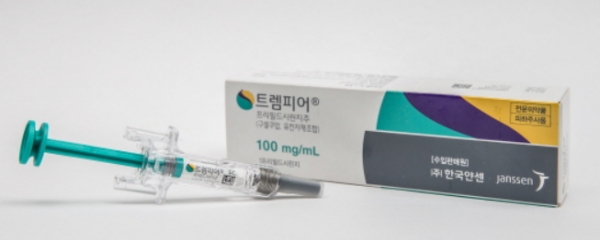
얀센은 판상형 건선 치료신약 '트렘피어(성분명 구셀쿠맙)' 적응증 추가에 적극적인 모습이다. 지난 10일 중증도·중증 활성 궤양성 대장염 유효성·안전성을 확인하기 위한 제2b/3상을 승인받았다.
트렘피어는 인터루킨-23(IL-23)의 하위 단백질인 p19과 선택적으로 결합해 IL-23의 신호전달 경로를 차단 또는 저해하는 기전으로 인터루킨-23을 선택적으로 차단하는 최초의 생물학적제제다.
바이엘과 로슈는 모두 진행성·전이성 고형암 환자를 위한 표적항암제 개발에 나섰다. 먼저, 바이엘은 BAY 1163877정(로가라티닙)을 임상시험 등록환자들에게 지속 투여하기 위한 연장 임상을 승인받았다.


로가라티닙은 FGFR 변이 표적항암제다. 바이엘은 그동안 폐암, 방광암 등에 치료 효과를 확인하기 위해 5년 여간 임상 연구를 진행해오고 있다. FGFR은 과도하게 활성화 되면 고형암 세포가 빨리 성장한다. 로가라티닙은 이를 차단해 암을 치료한다. 로슈도 PD-1/TMI-3 이중특이적 항체인 'Ro 712-1661'을 가지고 진행성 및/또는 전이성 고형 종양 환자에게 안전성, 약동학 및 예비 항종양 활성을 평가하는 1상을 진행하게 됐다.
PD-1은 활성화된 T세포(면역세포)의 표면에 있는 단백질이다. 암세포 표면에 있는 단백질인 PD-L1, PD-L2가 T세포 표면에 있는 단백질 PD-1과 결합하면 T세포는 암세포를 공격하지 못한다. 면역항암제는 T세포의 PD-1 수용체에 달라붙어 암세포의 회피 기능을 억제하는데, MSD의 키트루다와 옵디보가 작용하는 원리다.
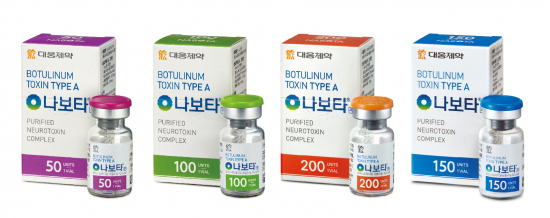
대웅제약의 보툴리눔 톡신 제제인 '나보타'로 남성형 탈모 치료 가능성을 보려는 연구자도 있었다. 지난 9일 임상 2b상을 신청한 단국대병원 피부과 박병철 교수는 남성형 탈모증을 겪는 환자를 대상으로 나보타의 유효성과 안전성을 평가할 예정이다.

CMG제약은 지난 4일 오르리스타트 제형 변경 임상 3상을 승인받았다. 현재 제로팻캡슐을 보유 중이다. 정제는 분할조제가 되고, 캡슐제형 대비 온도·습도에 안정적이라 휴대하기도 용이하다. 환자의 복약순응도도 높일 수 있다.
오르리스타트는 비만과 동반질환 치료에 쓰이는 전문약 중 유일하게 국내에서 허가·처방되고 있는 지방흡수억제제다. 지방 분해효소인 리파제 기능을 억제해 체내 지방 흡수를 감소시키는 역할을 한다. 중추신경계를 자극해 식욕을 억제하는 향정신성의약품과 다르다.
이와 관련, CMG제약 관계자는 히트뉴스와의 통화에서 "제품 라인업 확대 측면으로도 볼 수 있겠지만, 제형 변화에 주목해달라"고 했다. 현재 오르리스타트 성분 제제 시장 규모는 약 250억원에 달한다.

노바티스는 3제 흡입 요법(LABA/LAMA/ICS)을 투여 중인 COPD(만성폐쇄성질환) 환자에게 경구제 'QBW251'를 투여, 유효성·안전성을 확인하는 3상을 진행한다.
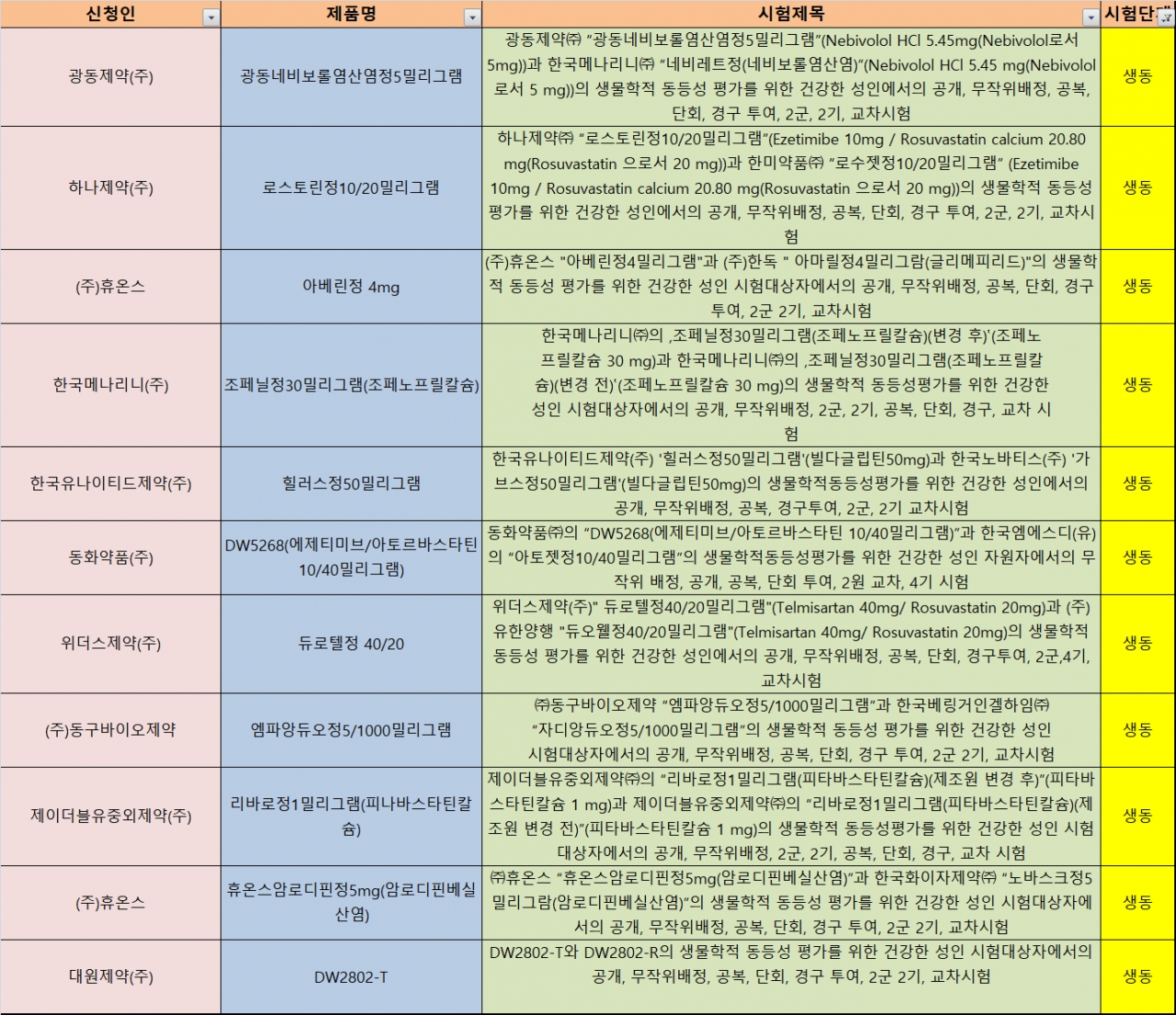
한편 지난 2주간 생동성 시험계획을 승인받은 사례, 연구자 임상시험 사례, 시험단계별로 구분한 제약바이오기업과 CRO의 임상시험계획 승인 사례는 다음과 같다.


관련기사
- 케이캡·슈가논, 적응증 확보 임상 박차
- 2주간 임상승인 40건 육박...일동, 치매 신약 3상
- NASH 등 치료제 없는 질환 신약 임상 박차
- 삼성바이오에피스, 솔리리스 시밀러 개발임상 착수
- 한미-단장증후군 신약·대웅-도네페질 패치 임상착수
- 2분기 실적 '저점' 찍은 유한양행, 3분기 반등 예상
- [임상승인] 2주간 30건 승인...대웅·유한 두드러져
- "건선치료 생물학적제제, 환자별 맞춤 처방해야 "
- "건선치료제 탈츠 사용한 환자 90% 이상 PASI 75 도달"
- 손발바닥 농포증 약 트렘피어, 국내 허가
- '엔브렐-휴미라' 꼭 집어 공략한 '탈츠-트렘피어'
- 얀센의 건선치료제 '트렘피어', 9월부터 건보 적용
- 당뇨·고지혈 복합제, 단일제 병용한 환자만 급여
- 트렘피어·아킨지오 급여등재 첫 관문 통과
- [브리핑] 미국서 희소식 전한 대웅...상반기 제약바이오 실적부진
- 대웅제약 수익성 개선, '나보타' 미국 수출이 견인
- 대웅제약 '나보타', 국제미용성형학회에서 우수성 입증
- 대웅제약 나보타, 눈꺼풀경련 적응증 획득
- 대웅 '보툴리눔톡신', 미국 현지 소비자 공략에 박차
- 대웅, 30여건 신규 임상 진행…"연구개발 경쟁력 강화"
- 대웅, R&D에 박차… '넥스트 나보타' 만든다
- 대웅, 보톡스 적응증 사업 착수…"적응증 확대 IND 제출"
- ‘트렐리지 엘립타’ 3제 요법 최초 유럽서 COPD 적응증 확대
- "COPD 치료, 경구제보다 흡입제가 더 유용"
- COPD 환자, LAMA/LABA 복합제 대비 악화 개선 효과 높아
- "악화 경험 COPD환자, 바헬바 조기투여 고려할만"
- GSK, COPD 3제 복합제 최초 국내허가 획득
- CMG제약, 비만치료제 '오르리스타트' 제형 변경
- 코오롱제약-COPD·광동-솔표 브랜드, 제품라인 강화
- 2주간 임상 46건 승인… 카티라이프·루게릭병 신약 주목
- 대웅, 나보타 차별화 임상 계속...이번엔 역가 직접비교
- 허가권고 6개월만에 대웅 나보타 이번엔 유럽 승인
- 케이캡, 적응증 확대 임상… 일동 자회사, 항암신약 도전
- 미용에서 치료분야로...보툴리눔 톡신 적응증 경쟁 치열
- 한림, 자가면역 신약 '류마티스' 넘어 '간 이식' 반응 확인

