(2019.06.24~07.05) 식약처, 최근 2주간 임상시험 45건 승인
최근 2주간 40건이 넘는 임상시험이 승인됐다. 단계별로는 1상이 15건으로 가장 많았고, 국내 제약사는 16곳이 승인받았다. 삼성바이오에피스의 솔리리스(성분명 에쿨리주맙) 바이오시밀러 개발 임상이 눈에 띈다.

한국비엠에스제약(이하 BMS)의 경우 신약 후보 물질 하나로 전신홍반루푸스, 궤양성 대장염, 판상 건선에 대한 임상을 잇달아 승인받기도 했다.
7일 식품의약품안전처에 따르면 지난달 24일부터 이달 5일까지 총 45건의 임상시험이 승인됐다. 신청인(중복 포함)별로는 제약·바이오기업 29건, 병원 8건, CRO(임상시험 수탁기관) 7건, 국가 항암신약개발사업단 1건 등으로 나타났다.
제약·바이오기업 중에서는 국내사 16곳, 다국적사 5곳이었다. 시험단계별로는 1상이 15건으로 가장 많았고, 연구자 임상과 생동 각 7건, 2상과 3상 각 6건, 1/2상과 1/2a상-1/3상 각 1건이었다.

BMS는 후보물질 'BMS-986165'를 가지고 지난 26일 궤양성 대장염 환자 대상 임상 2상과 이틀이 지난 28일 판상 건선 환자 대상 임상 3상을 연달아 승인받았다. 'BMS-986165는 선택적 티로신 키나제2(TYK2) 억제제로 TYK2는 면역과 염증 조절을 관리하는 JAK 효소 4가지 중 하나인데 TYK2만 선택적으로 억제한 후 건선을 치료하는 약물이다.
건선은 물론 루푸스, 크론병 등의 자가면역질환과 관련이 있는 것으로 알려져 여러 임상을 시도할 수 있다. 식약처에 BMS가 'BMS-986165'를 가지고 승인받은 임상은 루푸스, 크론병, 판상 건선, 궤양성 대장염 등 7건에 달한다.
동아에스티는 DPP-4 억제제로 쓰이는 슈가논(성분명 에보글립틴)이자 코드명 'DA-1229'의 새 적응증 확보에 열중이다. 지난달 24일 석회화가 동반된 대동맥판막 질환 및 대동맥 환자를 대상으로 안전성·유효성을 평가하는 임상 2상을 승인받았다.
동아 측은 DA-1229를 대동맥판막석회화증 치료제로 개발하기 위해 바이오벤처와 기술이전 계약을 맺고, 조인트벤처를 설립하기도 했다. 특히 에보글립틴의 '가능성을 찾겠다'는 목표로 NASH(비알코올성 지방간염) 치료제 등 여러 개발방안을 강구하고 있는 것으로 알려졌다.
삼성바이오에피스는 발작성 야간 혈색소뇨증 치료제 솔리리스(성분명 에쿨리주맙) 바이오시밀러 개발에 나섰다. SB12와 솔리리스를 비교하는 3상에 돌입한 것이다. 솔리리스는 미국 제약사 알렉시온이 개발했는데, 지난해 글로벌 시장에서 약 3조5000억 원의 매출을 올렸다.
대웅제약은 지난 3일 SGLT-2 치료제인 DWP16001를 메트포르민과 병용 투여 임상 1상을 승인받았다. 지난 5월 단독 투여요법으로 안전성·유효성을 평가하는 임상 2상에 착수하는 등 상업화에 박차를 가한 것으로 보인다.
GC녹십자는 전량 수입에 의존하던 백신 국산화에 한 발 더 가까이 갔다. 성인용 Td백신(파상풍·디프테리아 예방백신)에 백일해 항원을 추가한 파상풍·디프테리아·백일해(Tdap) 백신 임상 2상에 진입한 것이다.
녹십자는 "2년 안에 상용화를 목표로 한다"고 밝힌 것으로 알려졌다. 경쟁 약물은 사노피의 아다셀주, GSK의 부스트릭스주가 있다.
일동제약은 편두통 신약인 '라스미디탄'을도입하기 위해 지난달 27일 가교 임상을 승인받았다. 라스미디탄은 기존 트립탄계열 편두통 약물의 애로사항인 심혈관계 부작용이 없는 '디탄' 계열의 약물이다.
일동 측은 지난 2013년 오리지널 사인 미국 콜루시드와 계약해 국내에 도입하기로 계약을 맺었다. 아세안 8개국 판권도 같이 받았다. 이후 콜루시드는 2017년 릴리에 인수됐고, 약물을 확보한 릴리는 미국 FDA에 허가신청서를 제출한 상태다. 가교 임상은 해외 신약을 들여올 때 한국인의 특성을 반영하기 위해 진행하는 임상이다.
환인제약은 뇌전증 약물 'WID-ESL18'에 대한 가교 시험 1상을 진행한다. 환인은 지난해 2월 포르투칼 Bial사가 개발한 뇌전증 치료제 '제비닉스'의 독점 라이선스 계약을 체결한 바 있다. 1일 1회 용법의 신약으로 미국과 유럽에서 시판됐다.
주성분인 에스리카바제핀 아세테이트(Eslicarbazepine Acetate)는 유럽에서 신규 성인 환자의 부분발작에 대한 단독요법과 함께, 성인 및 6세 이상 환자에서의 부가요법으로, 미국에서는 성인 및 4세 이상의 뇌전증 환자 치료에 쓰이고 있다.
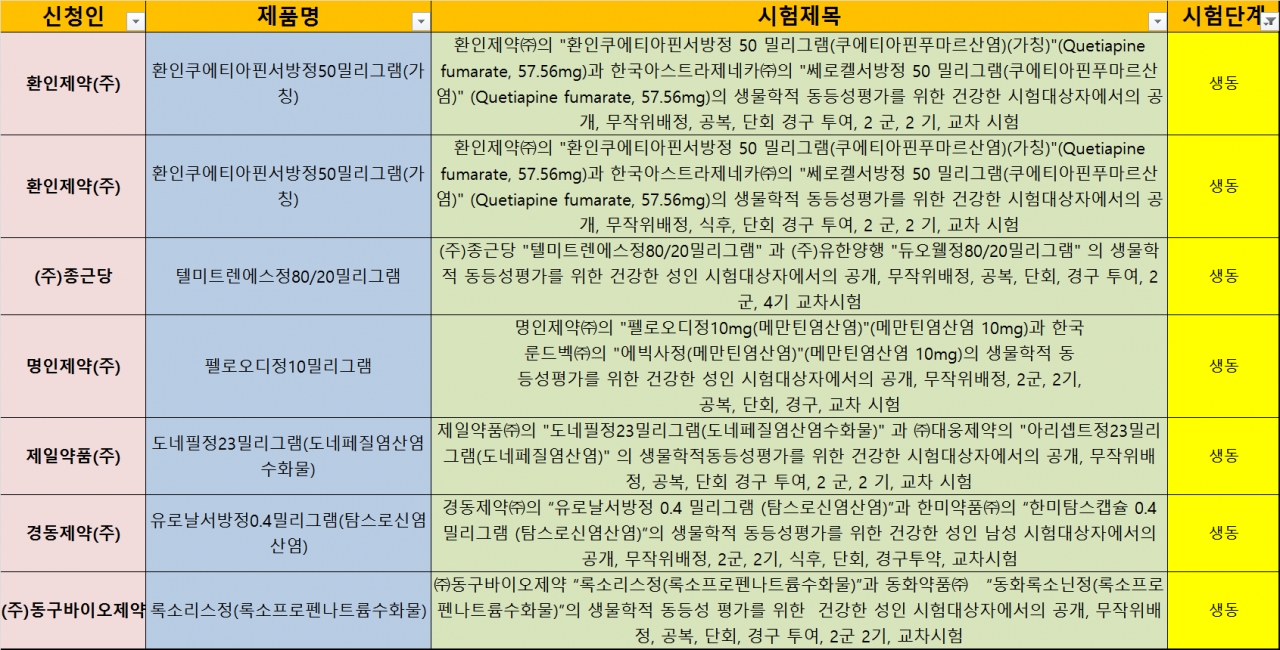
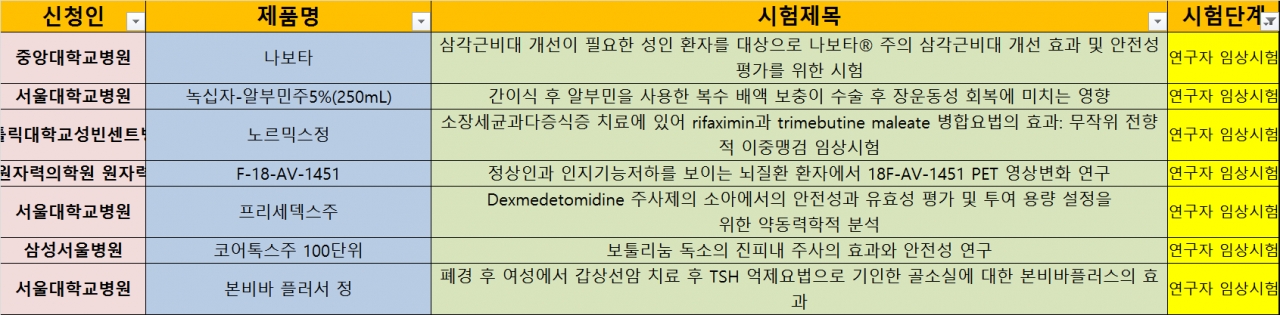
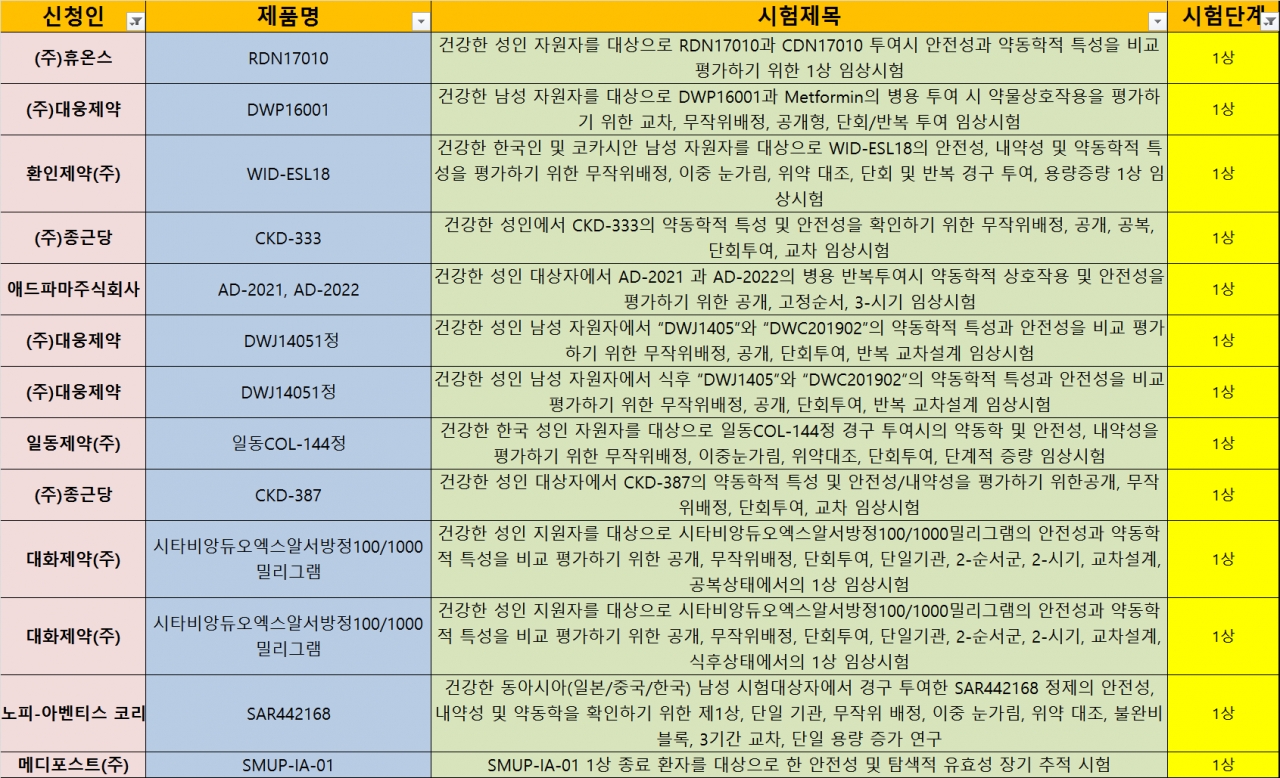
지난 2주간 생동성 시험계획을 승인받은 사례, 연구자 임상시험 진행 사례, 시험단계별로 구분한 제약바이오기업과 CRO의 임상시험 계획 승인 사례는 다음과 같다.