DNA를 직접 편집한다...유전자 가위의 원리
CRISPR-Cas9이 DNA를 찾아 자르고 수정하는 과정
CRISPR-Cas9 시스템은 유전자 편집을 가능하게 하는 놀라운 기술로, 이 기술을 사용하면 우리가 원하는 유전자 부분을 정확하게 찾아 수정하거나 교체할 수 있습니다. 이 과정은 여러 단계를 거쳐 진행됩니다. 그럼, 이 시스템이 어떻게 작동하는지 쉽게 풀어보겠습니다.

심예슬의 모달리티 여행기
ⓛ 타깃 단백질, 쓰레기장으로 인도하는 TPD
② 벡터 달고 세포 파괴하는 RPT
③ T세포 커스텀하는 CAR-T
④ 유전자치료를 전달하는 AAV 기반 유전자치료제
⑤ 과도한 단백질 발현 원천 차단, RNAi
⑥ 유전자 가위, CRISPR-Cas9 시스템
우리의 유전자는 우리 몸의 모든 기능을 규명하고 결정짓는 중요한 정보를 담고 있습니다. 각 유전자는 특정 단백질을 만들기 위한 설계도를 제공하고, 그 단백질은 우리의 생리적 기능을 유지하는 데 필수적이죠. 하지만 때때로 유전자에 결함이 생기면, 그것이 바로 질병을 유발할 수 있습니다. 그럼에도 불구하고 최근 CRISPR-Cas9과 같은 혁신적인 유전자 편집 기술이 이러한 결함을 교정하고, 유전적 질병을 치료하는 새로운 가능성을 열어주고 있습니다.
CRISPR-Cas9 시스템은 지도를 보고 목표를 찾는 과정과 가위를 이용해 잘라내는 과정으로 비유할 수 있습니다. 먼저 CRISPR 시스템은 유전자에서 필요한 부분을 찾아내는 지도 역할을 하고, Cas9 단백질은 유전자를 정확하게 자르는 가위 역할을 합니다.
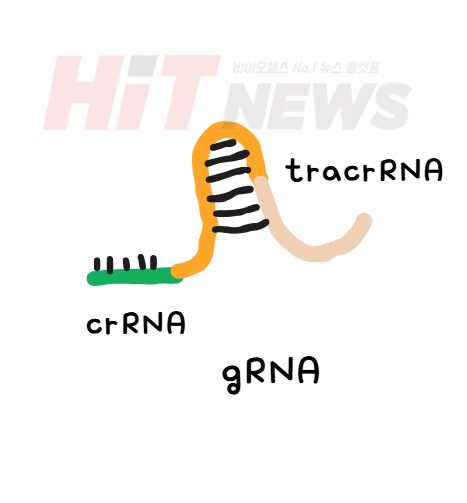
이 시스템에서 가장 중요한 역할을 하는 것은 guide RNA (gRNA)입니다. 이 gRNA는 우리가 수정하고자 하는 유전자 부분을 정확히 찾아내는 지도의 역할을 합니다. 마치 우리가 길을 잃었을 때, 특정 주소를 알려주는 지도가 필요한 것처럼, gRNA는 Cas9이 정확히 어떤 위치를 잘라야 할지 알려주는 중요한 역할을 하지요. 이 gRNA는 두 부분으로 나눠져 있습니다. 하나는 crRNA라는 부분으로, 유전자 서열을 찾아내는 부분이고, 다른 하나는 tracrRNA로, crRNA와 함께 Cas9이 잘 작동할 수 있도록 도와주는 친구 같은 역할을 합니다. 즉, gRNA는 타깃 DNA를 정확히 찾아주는 지도이자, Cas9을 도와주는 친구라고 할 수 있습니다.

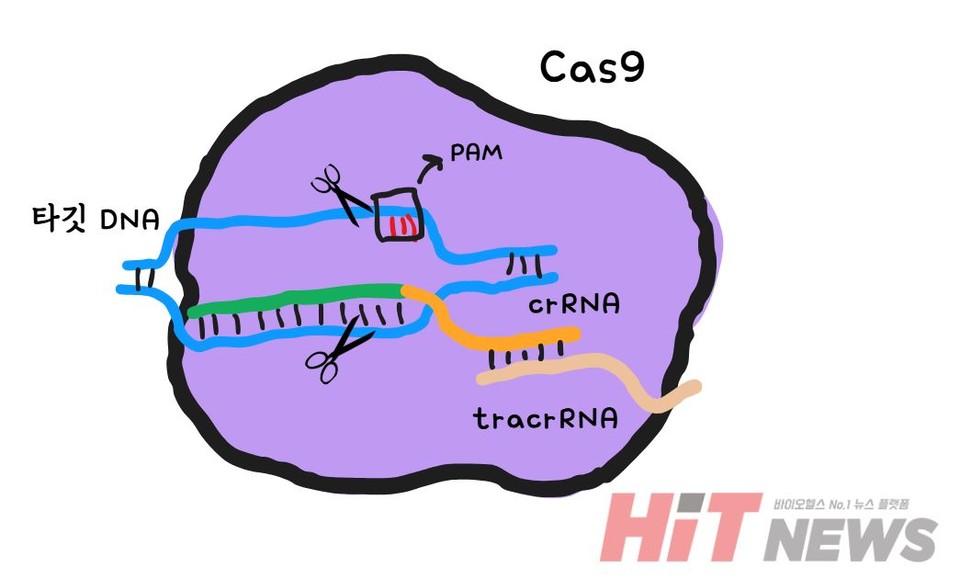
이제 gRNA가 목표로 삼은 타겟 DNA를 자르기 위해 Cas9이 등장합니다. Cas9은 유전자 가위 역할을 하는 단백질로, gRNA의 안내를 받아 유전자를 정확하게 절단합니다. Cas9은 마치 가위처럼 DNA 이중 나선을 정밀하게 절단하여, 유전자 편집의 시작점을 만들어 줍니다.
하지만 중요한 점은 Cas9이 아무 곳에서나 DNA를 자를 수 없다는 것입니다. Cas9이 정확한 위치를 찾기 위해서는 특정한 신호가 필요합니다. 이 신호가 바로 PAM(Protospacer Adjacent Motif)입니다. PAM은 Cas9이 타겟 DNA를 인식하고 자를 수 있도록 돕는 표식 같은 역할을 합니다. gRNA가 타겟 DNA에 결합한 뒤 Cas9이 PAM 서열을 확인하면 비로소 DNA 절단이 일어납니다.
CRISPR-Cas9 시스템을 통해 DNA를 절단하면, 세포는 손상된 부분을 복구하려는 반응을 보입니다. 이 과정에서 다양한 변화가 일어날 수 있습니다. 먼저, 세포는 절단된 DNA를 직접 다시 붙이려고 합니다. 하지만 이 과정에서 작은 삽입이나 결실(Indel)이 발생할 수 있습니다. 이는 유전자의 기능을 변화시키거나, 특정 유전자가 비활성화되는 결과를 초래할 수도 있습니다. CRISPR-Cas9 시스템을 통해 단순히 유전자를 자르는 것만이 아니라, 원하는 방식으로 다시 연결하거나 새로운 정보를 추가하는 것도 가능합니다. 이러한 복구 메커니즘을 활용하면 유전자 변이를 교정할 수도 있고, 특정 유전자의 기능을 조절하거나 전혀 새로운 기능을 부여하는 것도 가능합니다
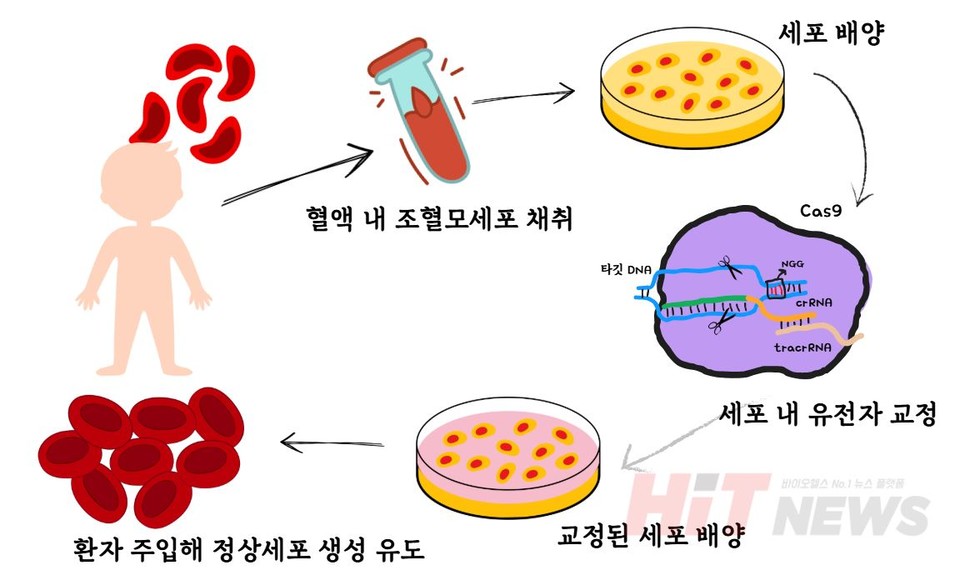
간단한 하나의 예시로, CRISPR-Cas9 시스템을 이용한 겸상적혈구병(SCD) 치료 과정을 살펴봅시다. 이 과정은 여러 단계를 거쳐 유전자 교정이 이루어집니다.
먼저, 환자의 혈액을 채취합니다. 겸상적혈구병 환자는 비정상적인 겸상적혈구를 생성하는데, 이 적혈구는 낫 모양으로 변형된 형태로 인해 혈액의 흐름을 방해하고, 통증이나 합병증을 유발할 수 있습니다. 이를 해결하기 위해 환자의 혈액에서 조혈모세포를 분리합니다. 조혈모세포는 혈액을 생성하는 중요한 세포입니다.
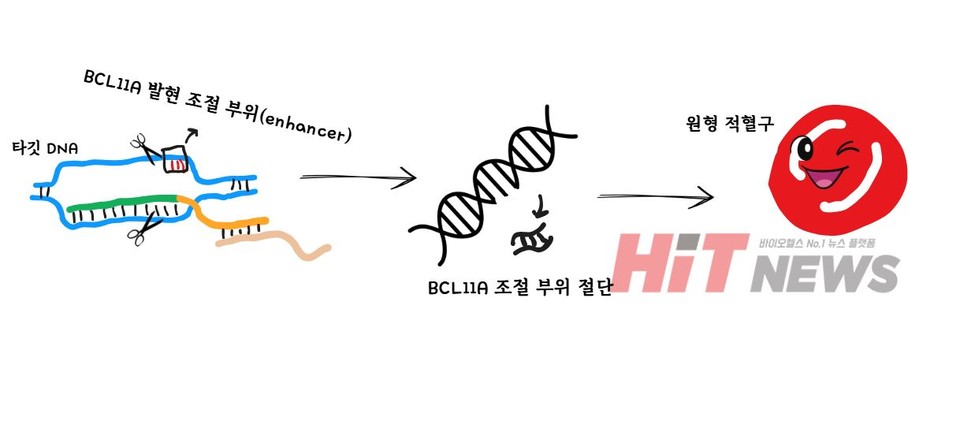
분리된 조혈모세포는 실험실에서 배양한 후 유전자 교정에 들어가게 됩니다. gRNA는 타깃 DNA를 정확히 찾아주고, Cas9 효소는 해당 부위를 절단하여 유전자 교정을 가능하게 하죠. 이 과정에서 특정 유전자의 발현이 조절되거나 억제되며, 결과적으로 겸상적혈구의 생성이 억제되거나 정상적인 적혈구가 만들어질 수 있도록 유도됩니다.
유전자 교정이 완료된 세포는 다시 배양되어 충분한 양이 확보되면 환자에게 주입됩니다. 수정된 세포는 환자의 몸에서 정상적인 적혈구를 생성할 수 있도록 유도하며, 결과적으로 낫 모양의 적혈구가 정상적인 원형 적혈구로 대체되면서 질병의 근본적인 원인을 해결할 수 있습니다.
CRISPR-Cas9 기술을 기반으로 한 대표적인 치료제가 바로 '카스게비(Casgevy)'입니다. 카스게비는 버텍스(Vertex)와 크리스퍼 테라퓨틱스(CRISPR Therapeutics)가 공동 개발한 세계 최초 CRISPR 기반 유전자 편집 치료제입니다. 현재 겸상적혈구병과 수혈 의존성 베타 지중해빈혈(TDT) 치료제로 승인되어 사용되고 있지요.
겸상적혈구병과 베타 지중해빈혈은 혈액 내 산소를 운반하는 단백질인 헤모글로빈을 만드는 베타글로빈 유전자에 이상이 생기거나 부족할 때 발생하는 질환입니다. 헤모글로빈은 적혈구 안에 들어 있는 중요한 단백질로, 산소를 몸 곳곳으로 운반하는 역할을 합니다.
연구자들은 이 문제를 해결하기 위해 태아 시절의 헤모글로빈 생성 방식에서 힌트를 얻었습니다. 태아는 출생 전까지 베타글로빈 대신 감마글로빈을 사용하여 헤모글로빈을 생성합니다. 하지만 출생 후에는 감마글로빈의 생성이 억제되고, 대신 베타글로빈이 활성화됩니다.
감마글로빈의 생성을 억제하는 단백질이 BCL11A입니다. 연구자들은 CRISPR-Cas9 기술을 이용해 BCL11A의 인핸서(enhancer) 영역을 절단하여 BCL11A의 발현을 낮추면 감마글로빈을 만드는 유전자의 발현이 다시 활성화될 수 있다는 점을 발견했습니다. 인핸서는 특정 유전자의 발현을 조절하는 부위입니다. 감마글로빈의 생성이 다시 활성화되면, 성인이 되어서도 태아형 헤모글로빈(HbF)이 유지될 수 있습니다.
태아형 헤모글로빈은 감마글로빈과 알파글로빈으로 이루어진 헤모글로빈으로, 태아가 엄마로부터 산소를 더 효율적으로 공급받을 수 있도록 돕는 역할을 합니다. 겸상적혈구병과 베타 지중해빈혈 환자는 베타글로빈이 변형되었거나 부족하기 때문에, 성인형 헤모글로빈이 정상적으로 기능하지 못합니다. 연구자들은 이를 해결하기 위해 태아형 헤모글로빈의 생성을 촉진하는 전략을 개발한 것이죠.
태아형 헤모글로빈의 비율이 증가하면, 부족했던 베타글로빈을 대신해 정상적인 헤모글로빈을 형성할 수 있고, 결과적으로 적혈구가 정상적으로 기능하게 됩니다. 이를 통해 겸상적혈구병과 베타 지중해빈혈 환자들은 단 한 번의 유전자 치료로 정상적인 혈액을 가질 수 있는 가능성을 얻을 수 있게된 것이죠.