릴리, 넥스트 치매 신약물질 '렘터네터그' 3상 승인
렘터네터그, 베타 아밀로이드 플라크 타깃해 제거
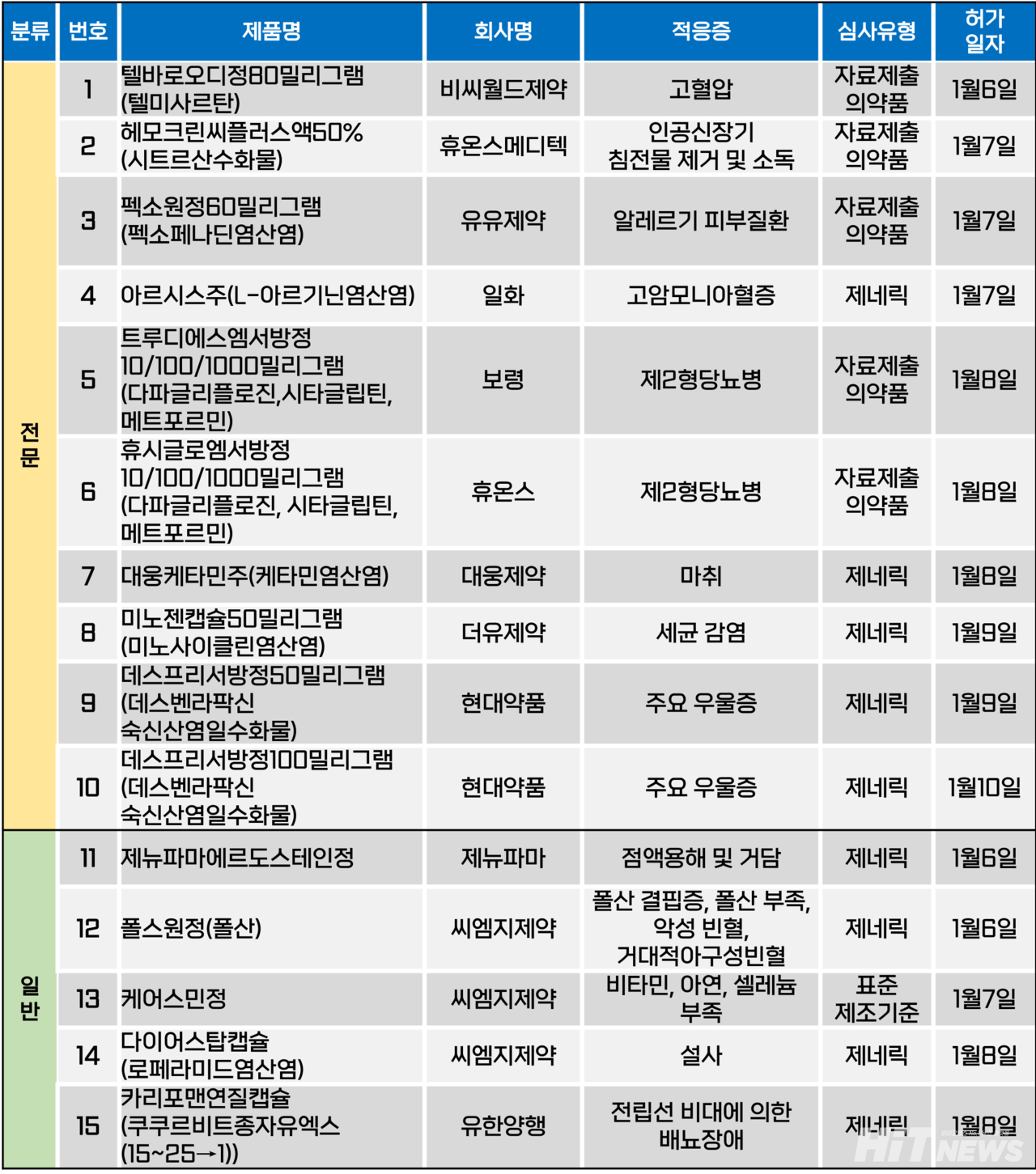
지난주(1월 6~10일) 총 15개 품목이 식품의약품안전처에서 품목허가를 받았다. 전문의약품은 10개, 일반의약품은 5개 품목이다. 이들은 고혈압, 고암모니아혈증, 제2형당뇨병, 주요 우울증 등 다양한 적응증으로 허가됐다.
기존 정제 형태로 판매되던 고혈압 치료제 '텔미사르탄' 제제의 구강붕해정 품목이 등장했다.
비씨월드제약은 지난 6일 '텔바로오디정80밀리그램(이하 텔바로오디, 성분 텔미사르탄)'을 허가 받았다. 국내 시장에서 구강붕해정의 텔미사르탄 제제가 허가된 건 이번이 처음이다.
텔미사르탄 오리지널 의약품은 베링거인겔하임의 '미카르디스'다. 비씨월드제약은 미카르디스의 제네릭을 모두 보유하고 있는데, 텔미사르탄 단일제 '비씨텔미', 히드로클로로티아지드 복합제 '테람핀에스' 등이다.
기존 정제 또는 캡슐 제형의 경구용 제네릭 개발에 주력하던 제약사들이 최근 새로운 약물 전달 시스템(DDS)을 적용한 제품을 선보임에 따라, 비씨월드제약 또한 구강붕해정 등 신규 제형 개발 움직임을 보이고 있는 것으로 파악된다.
지난 12월 12일 비씨월드제약은 책임경영과 주주친화 정책의 일환으로 현금배당 및 주식배당을 결정했다. 현금배당은 1주당 100원으로 2.5%의 시가배당율에 해당했으며, 당시 최대주주인 홍성한 대표는 주주가치 제고를 위해 3년 연속 현금 무배당을 결정하기도 했다.
이와 관련 회사 관계자는 "이번 결정은 비씨월드제약의 DDS기술, 구강붕해정, 장기지속형 주사제 개발 그리고 해외 라이선스인 전략 등을 통해 회사 성장에 대한 자신감과 그 성과를 주주에게 환원하고자 하는 것"이라며 후속 제품에 대한 기대를 드러냈다.
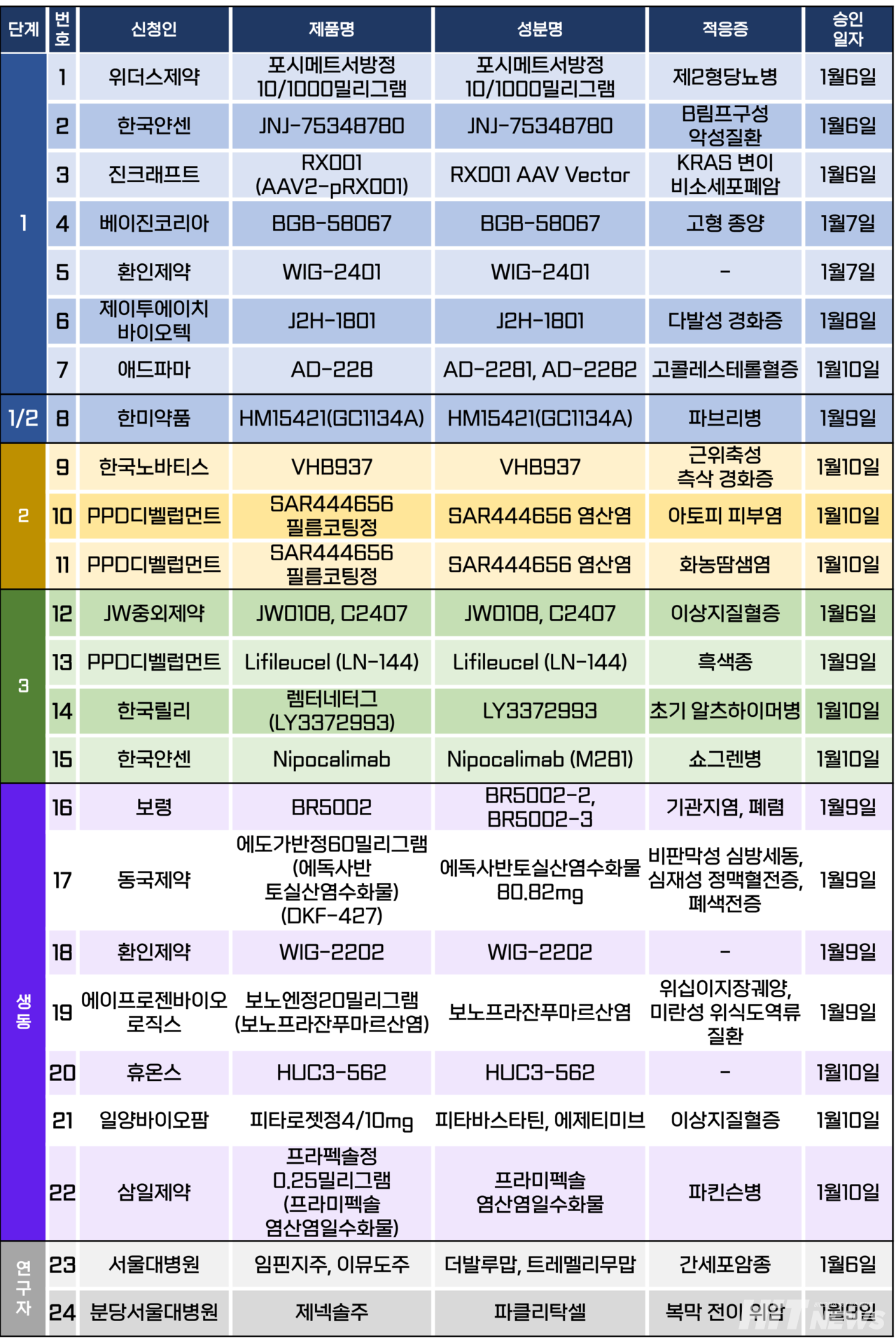
임상시험계획은 총 24건이 승인됐다. 세부적으로 △1상 7건 △1/2상 1건 △2상 3건 △3상 4건 △생물학적 동등성 7건 △연구자 임상 2건 등이다. 이 임상시험들은 파브리병, 근위축성 축상 경화증, 아토피 피부염, 화농땀샘염, 이상지질혈증, 알츠하이머병, 쇼그렌병 등 질환과 비소세포폐암, 흑색종, 간세포암, 위암 등 암종을 대상으로 승인됐다.
최근 치매 신약 '키썬라(Kisunlaㆍ성분 도나네맙)'의 미국 FDA 허가를 획득한 일라이 릴리가 또 다른 신약 '렘터네터그(Remternetug·연구물질명 LY3372993)'의 국내 3상 임상시험을 진행한다.
렘터네터그는 초기 알츠하이머병 치료 단일클론항체로, 키썬라와 마찬가지로 변형된 베타 아밀로이드(Aβ)인 'N3pG'를 타깃해 제거하는 신약물질이다.
한국릴리는 지난 10일 인지 및 기능 감소의 위험이 있는 초기 알츠하이머병 시험대상자에서 렘터네터그와 위약의 유효성 및 안전성을 비교하는 3상 임상시험계획(연구명 TRAILRUNNER-ALZ 3)을 식약처로부터 승인받았다.
이번에 승인된 임상은 55세부터 80세까지의 성인 환자 100명(글로벌 1200명)을 대상으로 진행되는 연구로, △연세대 원주세브란스기독병원 △칠곡경북대병원 △충북대병원 △제주대병원 △이화여대 의대부속서울병원 △길 병원 △아주대병원 △가톨릭대 서울성모병원 △인하대 의대부속병원 △부산대병원 △연세대 의대 강남세브란스병원 △서울아산병원 △서울대병원 △전남대병원 △분당서울대병원 △한양대병원 △삼성서울병원 △건국대병원 등 의료기관에서 2030년 12월까지 진행될 예정이다.
연구진은 1차 유효성평가변수를 피하 투여 후 최대 255주차까지 임상치매평가척도(CDR)로 측정한 임상적으로 의미있는 진행(Time to Clinically Meaningful Progression)으로 설정했다. CDR은 초기 알츠하이머병의 연속선상에서 참가자의 질환 중증 단계와 손상 정도를 전반적으로 평가한다.
한편, 렘터네투그의 1상 임상결과는 지난 2023년 4월 글로벌 컨퍼런스에서 공개된 바 있다.
당시 릴리 측은 외신과의 인터뷰에서 41명의 초기 알츠하이머병 환자를 대상으로 진행한 결과 투여 169일차 긍정적인 베타 아밀로이드 플라크의 제거를 확인했다고 설명했다.
다만, 렘터네투그를 투여받은 24명의 환자 중 10명에서 '아밀로이드 관련 영상 이상(Amyloid-Related Imaging Abnormalities·ARIA)’ 중 뇌 부종(ARIA-E)이 발견됐고, 7명에서 미세출혈(ARIA-H)이 보고됐다.
이 외에도 2022년 8월부터 초기 알츠하이머병 환자 900명 이상을 대상으로 정맥주사(IV) 또는 피하주사(SC) 주입 간 위약과 렘터네투그의 유효성 및 안전성을 확인하기 위한 3상 임상시험을 진행 중에 있다. 미국 74개, 일본 3개 의료기관에서 진행중인 이 연구는 2026년 3월 완료될 예정이다.

