심평원, 제11차 약제급여평가위원회 결과 공개
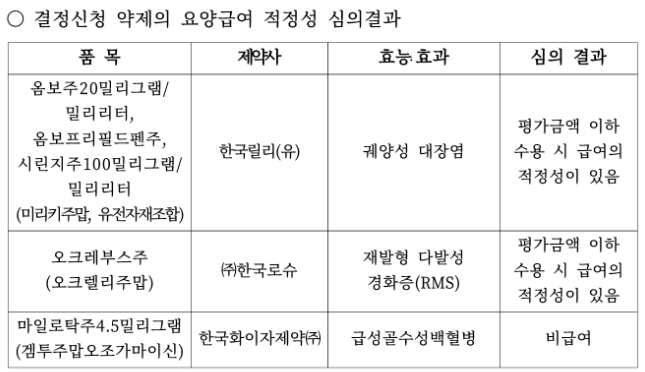
옴보주·오크레부스주 평가금액 이하 수용 시 급여 인정

한국화이자제약의 급성골수성백혈병(AML) 치료제 '마일로탁주4.5㎎(성분 겜투주맙오조가마이신)'가 비급여 판정을 받았다.
건강보험심사평가원은 7일 제11차 약제급여평가위원회를 개최하고 이같은 결과를 공개했다.
마일로탁은 CD33 표적 단클론항체와 세포독성 약물인 '칼리키아마이신'으로 구성된 항체-약물 접합체(ADC)로, CD33 항원을 발현하는 세포에 작용해 암세포 성장을 차단한다. 지난 2019년 국내 희귀의약품으로 지정됐으며, 2021년 'CD33 양성 AML 성인 환자의 1차 치료'에 품목 허가를 획득했다.
이후 세 번 도전 만에 중증(암)질환심의위원회를 통과했고 1년 만에 약평위에 상정됐지만, 비급여 판정으로 급여권 진입과 멀어지게 됐다.
한국릴리의 '옴보주20㎎(성분 미리키주맙)' 등과 한국로슈의 '오크레부스주(성분 오크렐리주맙)'는 모두 평가금액 이하 수용 시 급여의 적정성이 있다고 결정됐다. 두 약제는 각각 '궤양성 대장염'과 '재발형 다발성 경화증(RMS)' 치료제다.
옴보는 궤양성 대장염 관련 염증에 작용하는 IL-23의 p19 아단위(subunit)를 선택적으로 표적하는 기전으로, 지난 2월 식품의약품안전처에서 허가를 받았다. 허가 적응증은 '보편적인 치료제 또는 생물학적 제제에 반응하지 않거나 반응이 소실되거나 또는 내약성이 없는 성인의 중등도에서 중증의 활동성 궤양성 대장염의 치료'에서다.
오크레부스는 지난 5월 RMS 치료제 최초로 식약처 품목 허가를 획득했다. RMS 환자들의 신경계 장애를 유발하는 탈수 현상에 영향을 미치는 CD20 발현 B세포를 선택적으로 표적하는 인간화 단일클론항체다.
임상적 독립증후군, 재발 완화형 RMS 및 활성 이차 진행형 RMS를 포함한 △성인의 재발형 RMS의 치료 △성인의 일차 진행형 RMS의 치료 등에 사용할 수 있다.