빔젤릭스, 유지요법 시 투여 간격 8주, 자가 주사 가능
화이자, 경구용 선택적 CDK4 억제제 'PF-07220060' 2상 승인
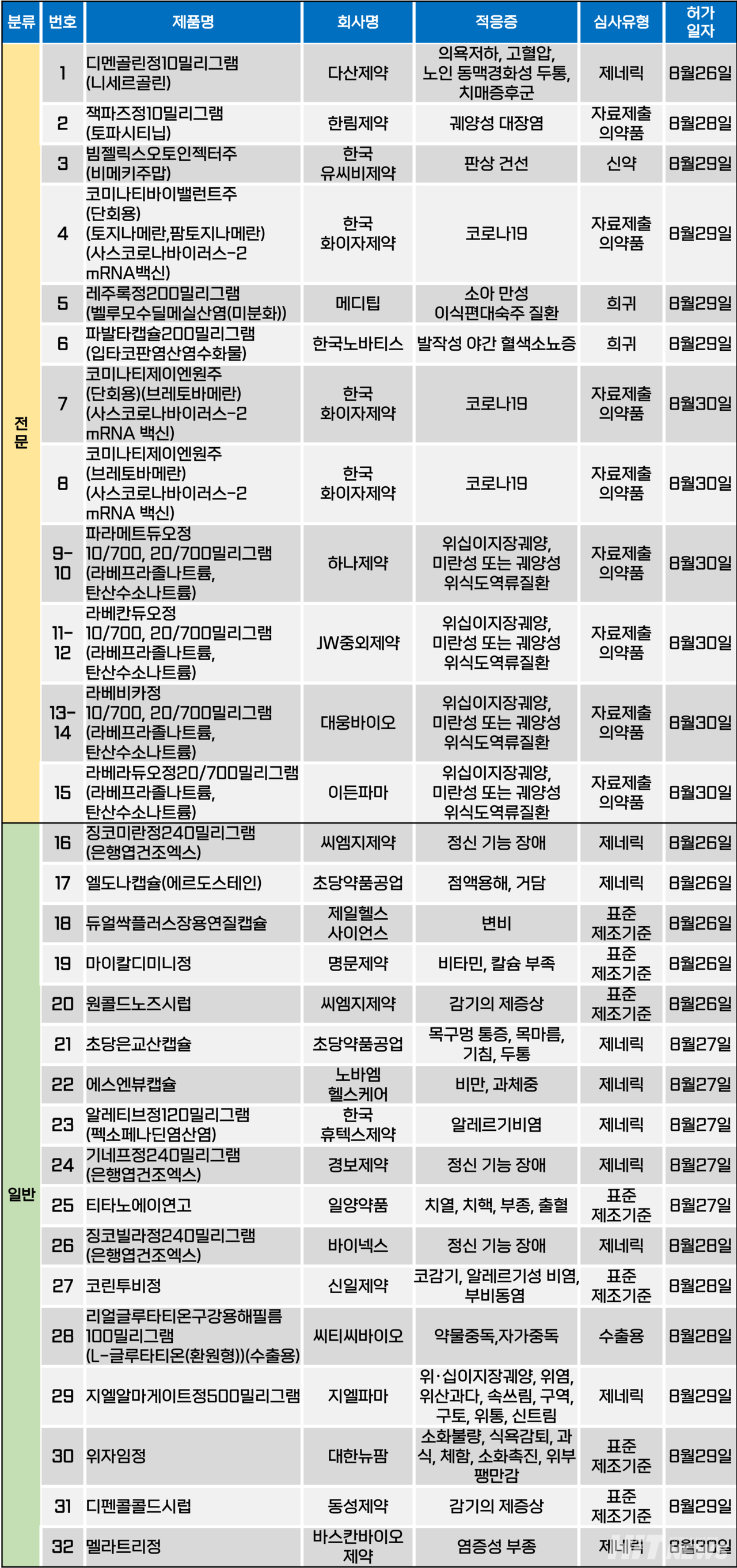
지난주(8월 26~30일) 총 32개 품목이 식품의약품안전처에서 품목허가를 받았다. 전문의약품은 15개, 일반의약품은 17개 품목이다. 이들은 치매증후군, 코로나19 감염, 소아 만성 이식편대숙주질환, 위·십이장궤양, 위식도역류질환, 발작성 야간 혈색소뇨증 등 다양한 적응증으로 허가됐다.
유씨비(UCB)가 개발한 판상건선 치료제 '빔젤릭스(성분 비메키주맙)'이 지난달 29일 식약처로부터 품목허가를 획득했다.
빔젤릭스는 건선 염증 과정의 중추적 역할을 하는 사이토카인(Cytokine) '인터루킨-17A(IL-17A)'와 '인터루킨-17F(IL-17F)'에 모두 작용하는 첫 이중 작용 억제제로, 광선요법 또는 전신치료요법을 필요로 하는 중등도에서 중증의 성인 판상 건선 환자의 치료 목적으로 허가됐다.
빔젤릭스의 용법용량은 처음 16주 동안 4주마다 피하주사로 320mg을 투여하고, 이후에는 8주마다 같은 용량을 투여한다. 병원에서 투여 받거나 교육을 통해 직접 자가 주사할 수 있다.
허가 주요 임상인 'BE READY' 연구 결과, 투약 16주차에 'PASI 90(90% 피부 증상 개선)'에 도달한 환자는 빔젤릭스 투여군이 90.8%, 'PASI 100(100% 피부 증상 개선)'인 환자는 68.2%로 나타났다. 또한 IGA 점수 0 또는 1('깨끗함' 또는 '거의 깨끗함')을 달성한 환자는 빔젤릭스 투여군의 92.6%였으며, 이는 위약군이 1.2% 대비 유의하게 높은 것으로 나타났다(p<0.0001).
또한 다른 생물학적제제와 비교한 3상 연구에서, 16주차에 PASI 100에 도달한 환자 비율은 △빔젤릭스군 59% vs 우스테키누맙군 21%(BE VIVID) △빔젤릭스군 60.8% vs 아달리무맙군 23.9%(BE SURE) △빔젤릭스군 61.7% vs 세쿠키누맙군 48.9%(BE RADIANT)로 나타났다.
이 중 BE RADIANT 임상에서 빔젤릭스는 최초 1회 투여 후 4주 만에 71% 환자가 PASI 75를 달성한 것으로 나타나, 47.3%를 보인 세쿠키누맙군 대비 투여 후 빠른 치료 유효성을 보였다.
회사 측에 따르면, 다수의 3상 임상시험을 통해 확인된 빔젤릭스의 PASI 100 도달률은 BE BRIGHT 공개연장연구 결과 3년간 유의미한 수준으로 유지된 것으로 나타났다. 또, BE VIVID, BE SURE, BE RADIANT 연구에서 16주차에 PASI 100을 달성했던 환자의 82%는 3년차에도 PASI 100 상태를 유지한 것으로 나타났다.
16주차에 PASI 100을 달성한 환자들의 삶의 질 척도 지수(DLQI-Dermatology Life Quality Index)에서 0 또는 1을 나타낸 환자는 16주차 76.3%에서 빔젤릭스 치료 3년차에 89.0%까지 증가한 것으로 나타났다.
한국유씨비제약 황수진 대표는 이번 빔젤릭스의 국내 허가와 관련 "다수의 임상시험에서 빔젤릭스의 장기 치료가 건선 환자들의 삶의 질에 중요한 이점을 제공하는 것이 확인된 만큼, 이를 바탕으로 국내 많은 건선 환자들이 빔젤릭스로 깨끗한 피부를 회복하고 더욱 높은 삶의 질을 영위하기를 바란다"며 "빔젤릭스의 신속한 건강 보험 등재를 통해 환자 및 의료진들이 빔젤릭스를 사용함에 제한이 없도록 최선의 노력을 기울일 것"이라고 전했다.
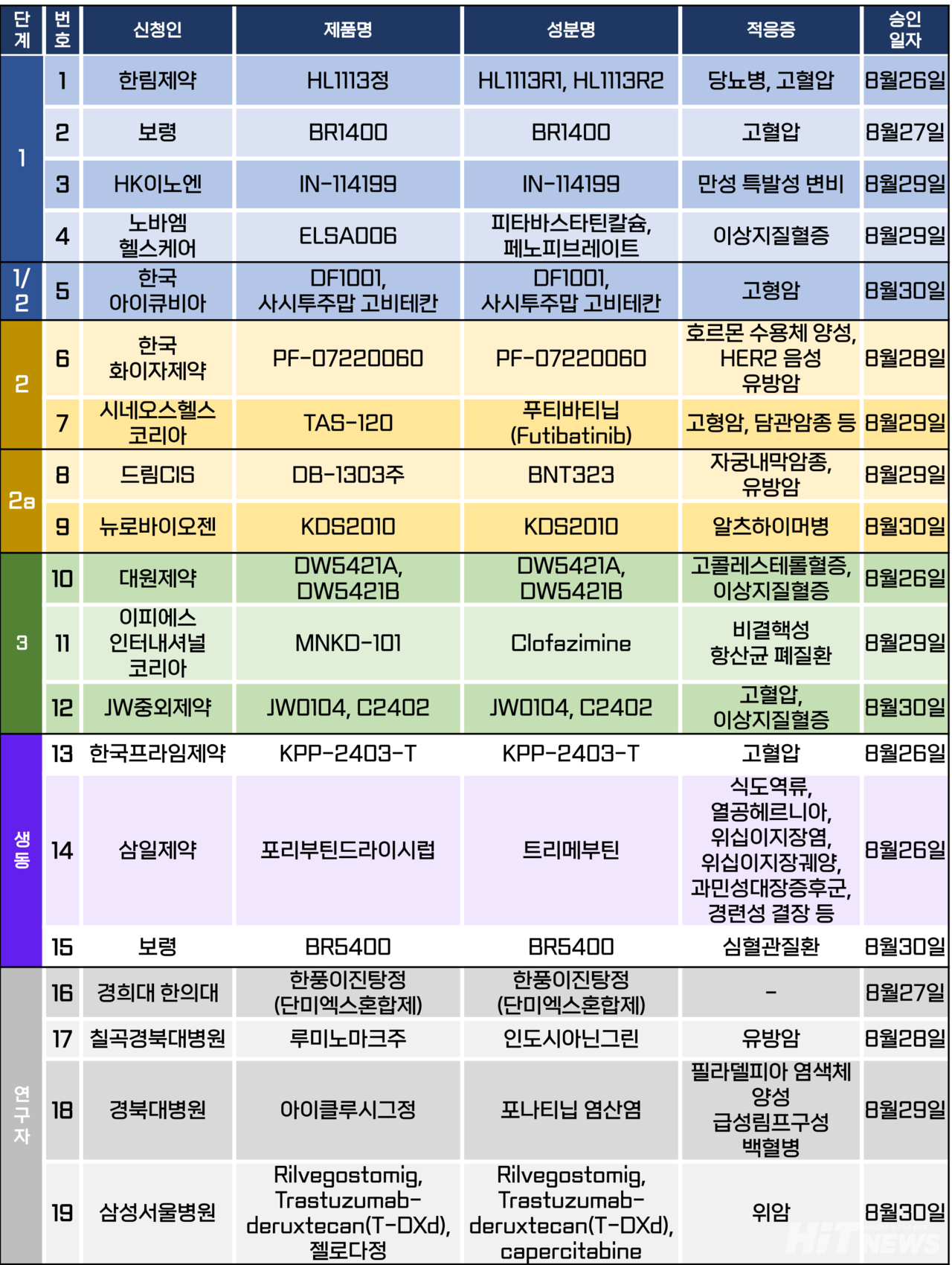
임상시험계획은 총 19건이 승인됐다. 세부적으로 △1상 4건 △1/2상 1건 △ △2상 2건 △2a상 2건 △3상 4건 △생물학적 동등성 3건 △연구자임상 4건 등이다. 이 임상시험들은 당뇨병, 고혈압, 만성 특발성 변비, 알츠하이머병, 이상지질혈증, 비결핵성 항산균 폐질환 등 질환과 유방암, 담관암, 위암 등 암종을 대상으로 승인됐다.
화이자가 개발 중인 경구용 선택적 CDK4 억제제 'PF-07220060'의 2상 임상시험계획이 지난달 28일 승인됐다.
PF-07220060은 회사가 보유한 CDK4/6 억제제 '입랜스(성분 팔보시클립)'와 마찬가지로 호르몬 수용체 양성, HER2 음성 유방암 환자를 대상으로 개발되고 있다.
이번 2상 임상은 호르몬 수용체 양성, HER2 음성 유방암 환자인 18세 이상 폐경 후 여성에서 선행 항암보조요법으로서의 PF-07220060과 레트로졸의 병용요법과 레트로졸 단독요법을 비교하는 중재적, 공개라벨, 무작위 배정, 다기관 연구다.
국내 환자 8명(글로벌 118명)의 참여를 목표로 2025년 10월까지 △세브란스병원 △서울아산병원 △서울대병원 등 의료기관에서 진행될 예정이다.
연구의 일차유효성평가변수는 △제14일 시점의 CCCA(완전한 세포 주기 정지) 비율(Ki 67 ≤2.7%), 이차유효성평가변수는 △모든 이상반응(AE), 심각한 이상반응(SAE), 시험약 중단을 초래한 AE의 발생률 △베이스라인 및 제14일 시점의 ctDNA 측정치 △PF-07220060의 Ctrough(혈청 최저 농도) 및 생검 전후 혈장 농도 △Ki-67 염색 등이다.
한편, 화이자는 PF-07220060와 선택적 에스트로겐 수용체 분해제(SERD) ‘풀베스트란트 제제와의 병용요법을 대상으로 3상 임상시험을 진행중에 있다. 29개국 356개 의료기관에서 약 500명의 환자를 대상으로 진행 중인 이 연구는 PF-07220060+풀베스트란트 병용요법과 풀베스트란트 단독요법 그리고 에베로리무스+에제메스탄 병용요법의 안전성 및 유효성을 비교한다.
관련기사
- 화이자, 입랜스 국내 허가 6주년 기념 사내행사 개최
- 유방암 치료제 시장, HER2 → CDK4/6 억제제로
- 유씨비 '빔젤스', 판상 건선 치료제로 허가 준비…2025년 출시 목표
- 존슨앤드존슨 "IL-23 억제제 건선 3상 효능·안전성 확인"
- IL-17A/F 이중 억제제 '빔젤릭스' 판상 건선 미충족 수요 개선 기대
- 올해 신약 2개 허가 '유씨비', 기세 몰아 내년 2개 품목 추가
- Bimzelx: A New Hope for Korean Psoriasis Patients
- UCB Eyes Two More Approvals After This Year’s Success
- "'피부 완전 개선' 내세운 빔젤릭스, 재발 잦은 건선 치료 새 대안"
- [허가/임상] 펙수클루, 20㎎ 품목 허가 …용량군 3개로 확대

