에리슨제약, 네비보롤+로수바 특허 기반 7번째 제품 허가
BMS, '터닝포인트'서 확보한 '레포트렉티닙'…비소세포폐암 3상 승인
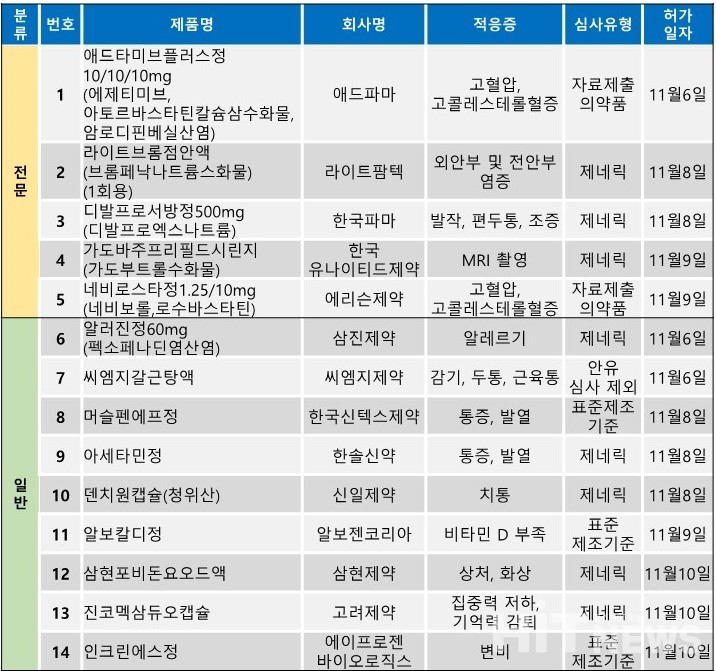
지난주(11월 6일~10일) 총 14개 품목이 식품의약품안전처로부터 품목 허가를 받았다. 전문의약품은 5개 품목, 일반의약품은 9개 품목이었다. 이 의약품들은 고혈압, 고콜레스테로혈증, 외안부 및 전안부의 염증, 발작 등 다양한 적응증으로 허가됐다.
에리슨제약이 고혈압 치료제 '네비보롤'과 고콜레스테롤혈증 치료제 '로수바스타틴'성분을 결합한 ‘네비로스타정’의 새로운 용량을 지난 9일 허가받으며, 제품군 확장에 나섰다. 이번에 허가 받은 용량은 1.25/10㎎(성분 네비보롤+로수바스타틴)이다.
네비보롤은 3세대 베타차단제 계열의 고혈압 치료제 성분으로 로수바스타틴과 결합한 복합제를 개발한 회사는 에리슨제약이 최초다. 회사는 앞선 2019년 △2.5/10㎎ △5/10㎎ △5/20㎎, 2020년 △1.25/5㎎ △2.5/5㎎, 2022년 2.5㎎/20㎎ 등 6개 제품군을 확보한 바 있으며, 지난해에는 이 제품군에 대한 '용출률이 개선된 네비보롤을 포함하는 약학적 조성물' 특허를 획득한 바 있다. 이 특허는 2036년 12월 15일 만료된다.
한편 에리슨제약은 지난 2018년 산업통상자원부의 '2018년 2차 바이오산업핵심기술개발사업'에 선정돼 다중 방출조절 및 다제형 기술 적용 만성질환 복합제 개발을 추진한 바 있다. 당시 회사는 이 과제를 통해 정부로부터 지원을 받아 '네비트롤(성분 네비보롤)'을 포함한 다양한 자사 만성질환 치료제의 복합제 개발에 나선 바 있다.
임상시험계획은 총 19건이 승인됐다. 세부적으로 △1상 3건 △1/3상 1건 △2상 4건 △2a상 1건 △3상 7건 △생물학적동등성 7건 △연구자 임상 2건 등이다. 이 임상시험들은 척수성 근위축증, 제2형 당뇨병, 재발성ㆍ불응성 B세포 호지킨 림프종, 전신성 중증 근무력증, 안구건조증, 골다공증 등 질환을 대상으로 승인됐다.
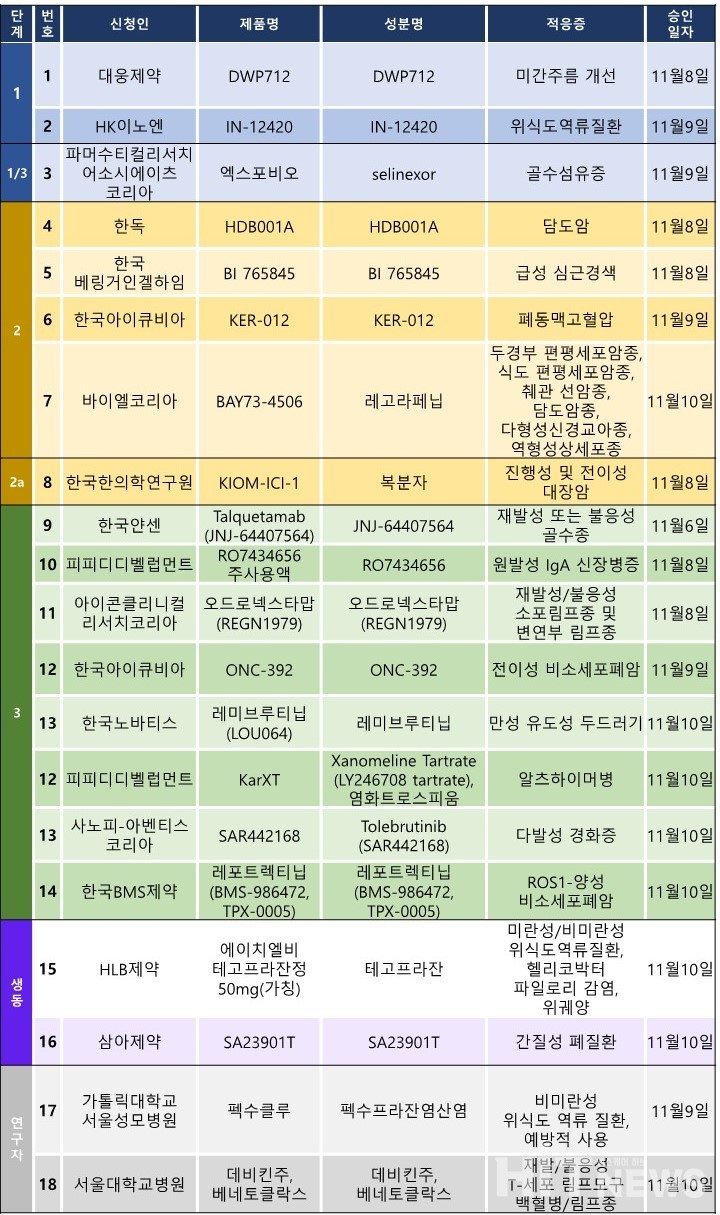
브리스톨마이어스스퀴브(BMS)가 개발 중인 ROS-1, NTRK 표적 고형암 치료제 '레포트렉티닙(Repotrectinib)'의 3상 임상시험계획이 지난 10일 승인됐다. 이번 임상은 '티로신 키나아제 억제제(TKI) 투여 경험이 없는 ROS1-양성 국소 진행성 또는 전이성 비소세포폐암' 환자를 대상자으로 진행되는 무작위 배정, 공개, 다기관 연구(연구명 TRIDENT-3)로, 대조약은 '젤코리(성분 크리조티닙)'다.
연구진은 이번 임상의 1차 유효성 평가변수를 '독립적 중앙 맹검 평가(BICR)에 의한 무진행 생존기간(PFS)'로 설정했다. 이 외에도 전체생존(OS), BICR 및 시험자에 의한 객관적반응률(ORR), 반응지속기간(DOR), 반응까지의 시간(TTR), 시험자에 의한 PFS 등을 2차 유효성 평가 변수로 정했다.
임상 목표 환자는 국내 23명(글로벌 230명)으로, 오는 2031년 1월까지 진행될 예정이다. 임상은 △분당서울대병원 △연세대 세브란스병원 △삼성서울병원 △서울아산병원 △충북대병원 등에서 진행된다.
한편 BMS는 지난 2022년 6월 미국 제약사인 '터닝포인트테라퓨틱스'를 인수하며, 레포트렉티닙을 자사 파이프라인으로 흡수했다. 이 약물의 주요 연구로는 TREDENT-1이 있는데, 조병철 연세암병원 교수는 지난 9월 열린 세계폐암학회(WCLC 2023)에서 해당 제제의 TRIDENT-1 임상 2상 결과를 발표한 바 있다.
당시 공개된 데이터에 따르면, 연구진은 이전 TKI 치료 경험이 없는 환자 71명과 항암화학요법 없이 한 차례 TKI로 치료를 받은 적 있는 환자 56명으로 구분해 레포트렉티닙의 효능을 분석했다. 18개월 시점의 ORR은 TKI 치료 경험이 없는 환자군에서 79%였으며, 이 중 기저 시점 뇌전이가 있는 환자(9명)에서는 89%로 나타났다. 반면 TKI 치료 경험이 있는 환자군에서는 각각 38%, 38%(13명)으로 나타났다.

