액제→정제 제형변경한 태준제약 장정결제 '수프렙미니정' 19일 허가
카미제스트란트, ER+/HER2- 초기 유방암 환자 대상 3상 진행
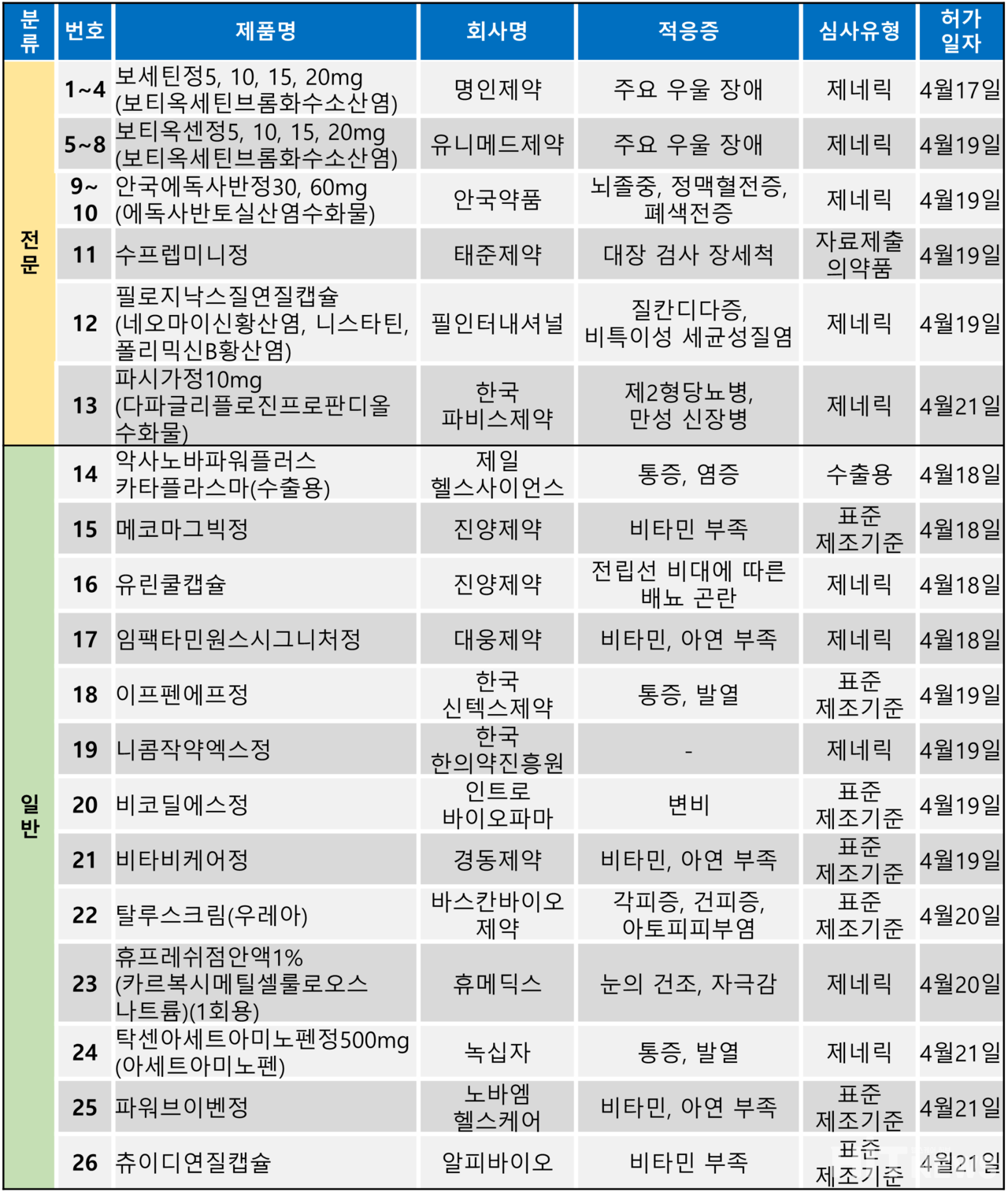
지난주(4월 17~21일) 총 26개 품목이 식품의약품안전처로부터 품목허가를 받았다. 전문의약품은 13개 품목, 일반의약품은 13개 품목이었다.
허가 품목들은 주요 우울 장애, 뇌졸중 및 색전증, 대장 검사 전 장세척, 질칸디다증, 제2형당뇨병 등 적응증으로 허가됐으며, 전문의약품 중 태준제약 '수프렙미니정'만이 자료제출의약품으로 허가됐다.
태준제약의 정제형 장정결제 '수프렙미니정'이 지난 19일 품목허가를 획득했다. 수프렙미니정은 회사가 보유하고 있는 OSS(Oral sulfate solution) 제제인 '수프렙액'의 제형을 액제에서 정제로 변경했을 뿐 성분은 동일하다.
수프렙미니정은 △무수황산나트륨 △황산칼륨 △무수황산마그네슘 등 주성분으로 구성됐으며, '대장(X선, 내시경)검사 시의 전처치용 장세척'으로 허가됐다.
투여 방법을 살펴보면, 성인의 투여 방법의 경우 검사 전날 이른 저녁에 160정을 473mL의 물과 함께 복용하고, 그 후 1시간 동안 물 473mL를 두 차례 더 복용해야 한다.
검사 당일에는 검사 전날 복용 후 10~12시간이 지난 검사 당일 오전에 이 약 160정을 473mL의 물과 함께 복용하고, 그 후 1시간 동안 물 473mL를 두 차례 더 복용해야 하고, 적어도 검사 2시간 전 또는 의사가 지시한 시간까지 이 약 복용 및 추가 물 섭취를 완료해야 한다.
총 320정의 약을 3L 가량 섭취해야 한다. 기존 액제는 장정결제 특유의 냄새, 맛 등으로 복용에 어려움이 있었다.
수프렙미니정의 허가 정보를 살펴보면, 임상시험 시 시메티콘 0.32g 정제 28정을 병용 투여 하도록 했다. 시메티콘은 주로 위장관에서 가스의 생성을 억제하는 가스제거제로 사용된다.
동일 유형의 제형을 살펴보면, 한국팜비오의 '오라팡정'이 있다. 수프렙미니정과 차이점은 '시메티콘' 성분이 더 추가되고, 정제의 크기가 조금 더 크다는 점이다. 대신 수프렙미니정과 같은 주기로 14정씩 2번만 복용하면 된다는 점이 특징이다.
한편 오라팡에는 현재 특허 도전이 이어지고 있다. 삼천당제약은 작년 11월 16일 오라팡의 '무수황산나트륨, 황산칼륨, 무수황산마그네슘 및 시메티콘을 포함하는 장관하제 경구투여용 고형제제 조성물' 및 '황산염을 포함하는 대장 하제 조성물' 특허에 무효심판을 제기했다. 또한 두 특허에 소극적 권리범위 확인 심판까지 제기하는 등 총 네 개 심판을 진행하고 있다.
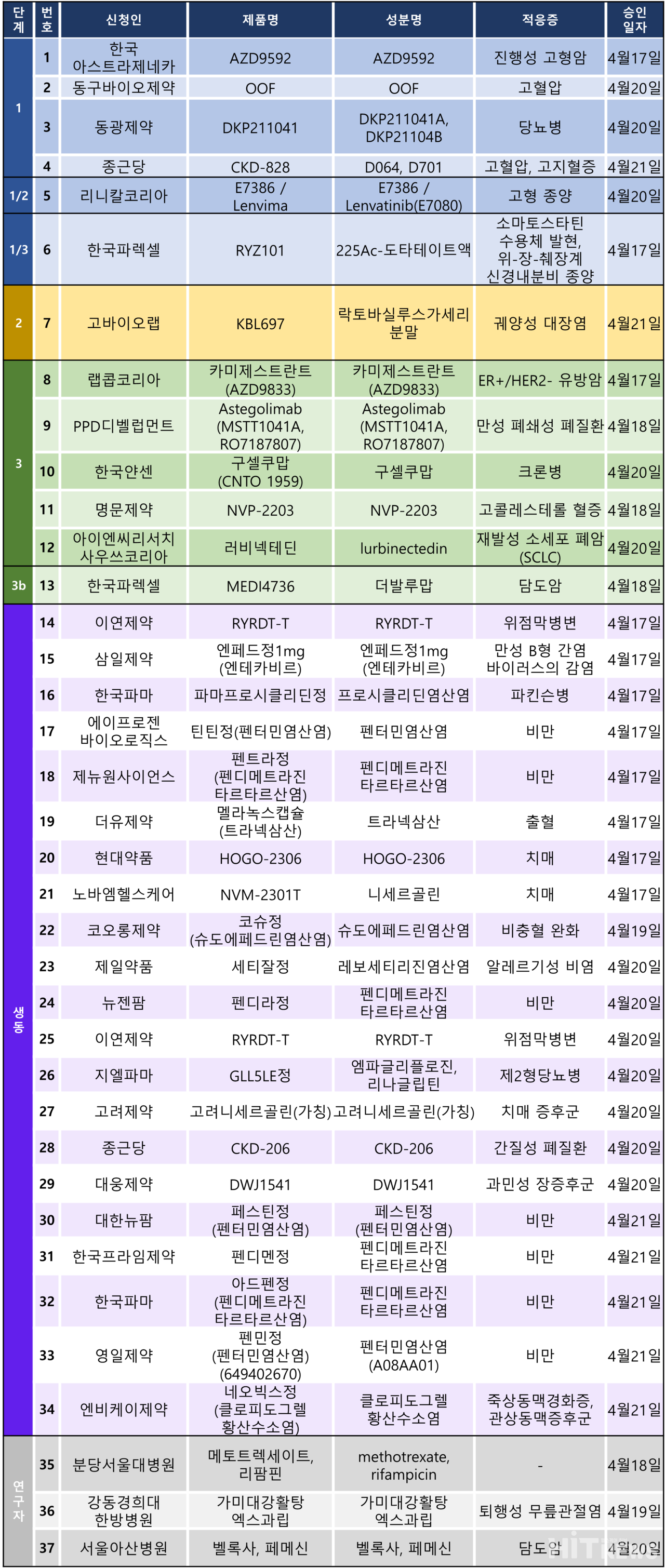
임상시험계획은 총 37건이 승인됐다. 세부적으로 △1상 4건 △1/2상 1건 △1/3상 1건 △2상 1건 △3상 5건 △3b상 1건 △생물학적동등성 21건 △연구자임상 3건 등이다.
이 임상 시험들은 고혈압, 고지혈증, 고형암, 궤양성 대장염, 유방암, 크론병, 담도암 등 다양한 질환을 대상으로 승인됐다.
아스트라제네카가 개발하고 있는 차세대 경구용 SERD(에스트로겐 수용체 특이적 분해제, Selective Estrogen Receptor Degrader) 항암제 '카미제스트란트'의 임상3상 시험계획이 지난 17일 승인됐다.
식약처는 이번 임상 3상(CAMBRIA-1)을 '근치적 국소구역 요법 완료 후 질병 재발 없이 2년 이상 표준 보조 내분비 기반 요법을 시행했으며, 재발 위험이 중위험 또는 고위험인 ER+(에스트로겐 수용체 양성)/HER2-(인간상피성장인자 수용체 2형 음성) 초기 유방암 환자를 대상으로 카미제스트란트 연장 요법의 유효성 및 안전성을 표준 내분비요법과 비교하여 평가하기 위한 공개, 무작위배정 시험'으로 승인했다. 표준 내분비요법은 아로마타제 억제제 또는 타목시펜이다.
임상 프로토콜을 살펴보면, 이번 임상은 표준 내분비요법를 대조군으로 LHRH(황체형성호르몬방출호르몬) 작용제와 병용하거나, 단일 연장 요법의 효과를 비교한다.
근치적 국소구역 요법 완료 후 질병 재발 없이 최소 2년에서 최대 5년간 표준 보조 내분비 요법을 시행했으며, 재발 위험이 중위험 또는 고위험인 ER+/HER2- 초기 유방암 환자 약 5375명(글로벌)을 스크리닝해 약 4300명을 선정, 1:1로 무작위 배정했다. 국내 임상 목표 환자수는 약 60명이다.
1차 유효성 평가변수는 IBCFS(침습성 유방암 무발생 생존)이며, 2차 유효성 평가변수는 △IDFS (침습성 질병 무발생 생존) △DRFS (원격 무재발 생존) △OS (전체 생존) 등이다.
임상은 △화순전남대병원 △연세대 강남세브란스병원 △고려대의대병원 △서울병원 △울산대병원 △삼성서울병원 △연세대 세브란스병원 △고려대 의대 부속 구로병원 △계명대 동산병원 △이화여대 의대 부속 목동병원 △가톨릭대 서울성모병원 △국립암센터 △인제대 해운대백병원 등 13개 의료기관에서 진행되며, 종료 예정일은 2028년 3월이다.
한편 아스트라제네카는 작년 카미제스트란트의 임상 2상(SERENA-2) 결과를 공개한 바 있다.
당시 회사는 자사 SERD 주사제 '파슬로덱스(성분 풀베스트란트)'와의 비교 임상에서, 75㎎(7.2개월)과 150㎎(7.7개월) 용량 모두 대조군(3.7개월) 대비 주요 유효성 평가변수인 PFS(무진행생존기간)을 충족했다고 발표했다. 대조군과의 질병 진행 및 사망 위험은 75mg 투약군이 대조군 대비 42%(HR=0.58, p=0.0124), 150mg 투약군은 33%(HR=0.67, p=00161) 더 낮은 것으로 나타났다.

