일반의약품만 15건 허가, 전문의약품 0건 그쳐
'BR1017' 임상 3상, 카나브+L50 병용투여 시 유효성 및 안전성 평가
BTK 억제제 브루킨사+오비누투주맙, 레날리도마이드+리툭시맙과 비교
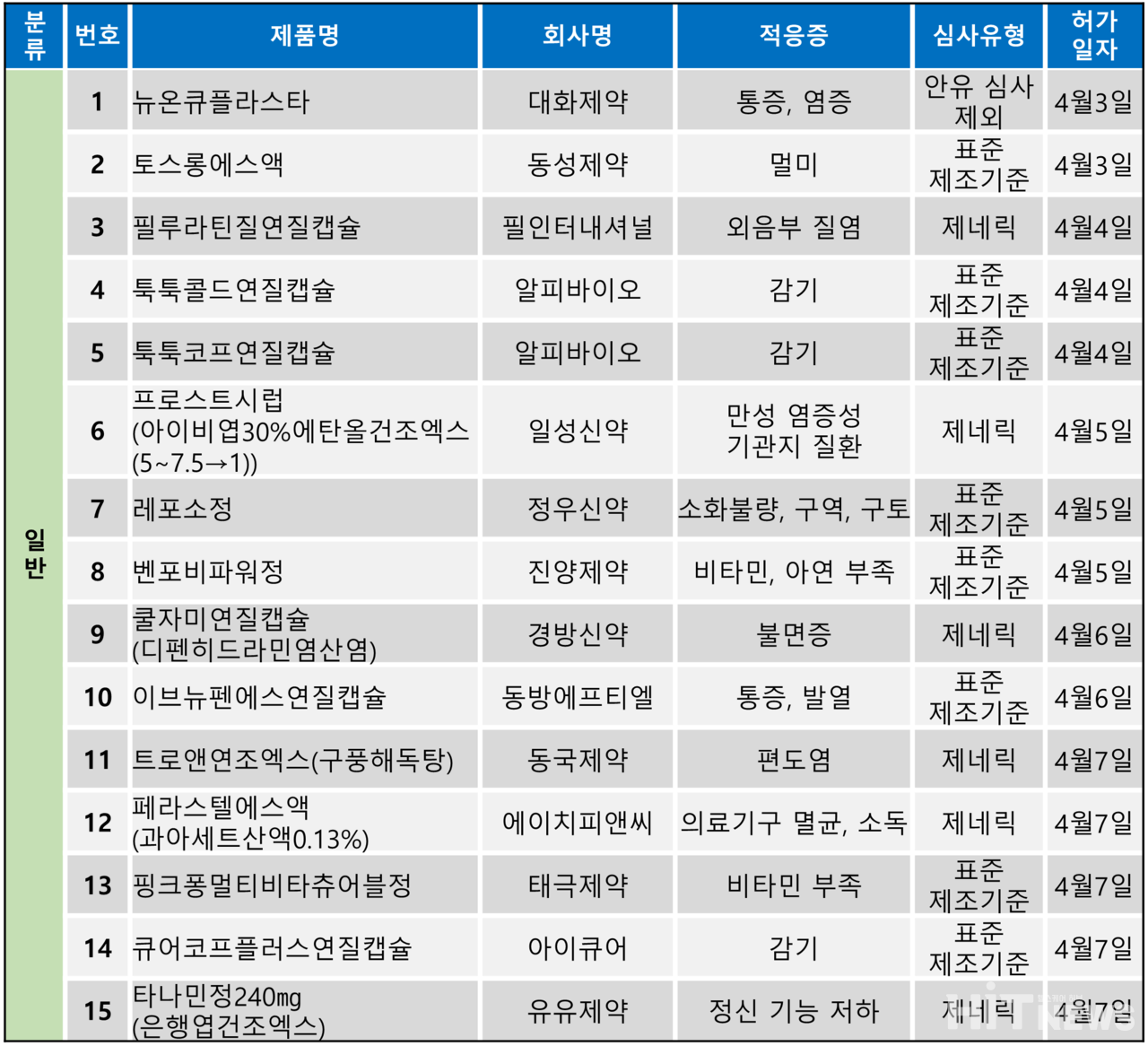
지난주(4월 3~7일)에는 총 15개 품목이 식품의약품안전처로부터 품목허가를 받았다. 허가 품목은 모두 일반의약품이었으며, 전문의약품은 한 건도 허가되지 않았다.
허가 품목들은 통증, 염증, 멀미, 감기, 비타민 및 미네랄 부족 등 적응증으로 허가됐다. 허가 품목들은 △안유(안전성 및 유효성) 심사 면제 △표준제조기준 △제네릭 등 심사 유형으로 허가됐으며 기타 특이사항은 없었다.
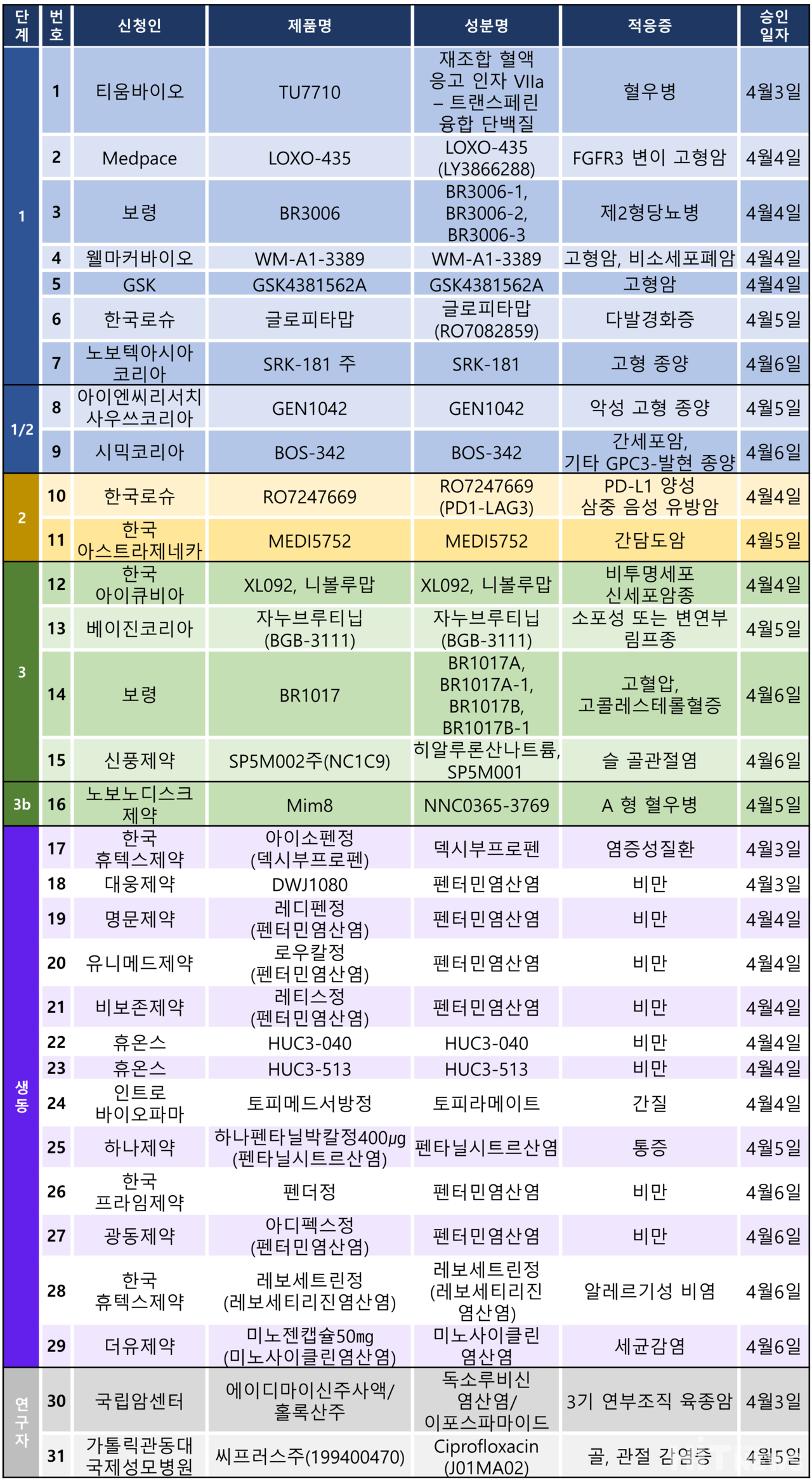
지난주 임상시험계획은 총 31건이 승인 완료됐다. 세부적으로 △1상 7건 △1/2상 2건 △2상 2건 △3상 4건 △3b상 1건 △생물학적동등성 13건 △연구자임상 2건 등이다.
이 임상 시험들은 혈우병, 제2형당뇨병, 고혈압, 다발경화증, 고콜레스테롤혈증, 비만 등 질환과 고형암, 비소세포폐암, 간담도암, 삼중음성유방암 등 다양한 암종을 대상으로 승인됐다.
보령이 개발 중인 고혈압, 고콜레스테롤혈증 복합제 'BR1017'의 임상 3상 시험계획이 지난 6일 승인됐다.
이번 3상 임상은 본태성 고혈압과 원발성 고콜레스테롤혈증을 동반한 환자에서 BR1017A와 BR1017B 단독투여 또는 병용투여 시의 유효성 및 안전성을 평가하기 위한 무작위 배정, 이중 눈가림, 다기관 시험이다. 회사는 2025년 3월까지 총 147명의 국내 환자를 대상으로 임상시험을 완료할 것이라는 방침이다.
회사 측은 지난 7일 공시를 통해 BR1017 개발 목적으로 피마사르탄 제제와 에제티미브+아토르바스타틴 제제 복합제를 개발해 고혈압, 고콜레스테롤혈증 환자 복약순응도 개선 및 병용투여 안전성, 유효성을 평가할 방침이라고 밝혔다.
이번 임상에 사용될 피마사르탄 제제는 보령의 대표 품목인 '카나브(성분 피마사르탄)'며, 에제티미브+아토르바스타틴 제제는 'L50'으로 추정된다.
회사는 현재 카나브 패밀리 중 고혈압·고콜레스테롤혈증 복합제로 투베로(성분 피마사르탄+로수바스타틴), 듀카로(성분 피마사르탄+암로디핀+로수바스타틴), 아카브(성분 피마사르탄+아토르바스타틴) 등을 보유하고 있다. 이번 임상 3상이 완료된다면 아카브에 에제티미브 성분을 추가한 8번째 카나브 패밀리 품목이 탄생하게 된다.
베이진코리아가 개발한 외투성 또는 변연부 림프종 치료제 '브루킨사(성분 자누브루티닙)'의 임상 시험 3상 계획이 승인됐다.
BTK(브루톤형 티로신 키나제, Brutons Tyrosine Kinase) 억제제로 작용하는 이 치료제는 악성 B세포의 생존, 확산을 억제하는 표적 항암제다.
현재 브루킨사는 △외투세포 림프종(MCL) 성인 환자에서의 단독요법 △발덴스트롬 마크로글로불린혈증(WM) 성인 환자에서의 단독요법 △재발성/불응성 변연부 림프종(MZL) 성인 환자에서의 단독요법 등으로 허가돼 있다. 모두 이전에 치료 경험이 있는 2차 치료로 사용할 수 있게 돼 있다.
이번 3상 임상은 브루킨사와 한국 로슈의 CD20 항체 '오비누투주맙'의 병용 요법을 '레날리도마이드+리툭시맙' 요법과 비교하는 무작위배정, 공개, 다기관 시험이다. 레날리도마이드+리툭시맙 병용요법은 'R2' 요법으로 알려진 소포림프종 2차 치료제다. 작년 4월 급여 등재돼 사용되고 있는 치료 요법이다.
회사 측은 2029년 6월까지 임상을 완료하는 것을 목표로 하며, 국내 임상 목표 수는 35명(글로벌 750명)이다.
한편 브루킨사는 베이진이 작년 2월 국내에 도입한 1호 치료제다. 작년 4월 암질환심의위원회로부터 발덴스트롬 마크로글로불린혈증 치료에 대한 심의를 40일 만에 통과했으며, 올해 2월에는 약제급여평가위원회로부터 급여 적정성을 인정받았다. 일반적으로 약평위를 통과한 60일 후 급여 고시되는 점을 감안할 때, 올해 상반기 중 적용될 것으로 전망되고 있다.

