젤잔즈시럽, 시럽제형으로 소아, 청소년 복약 편의성 개선
HLB생명과학, 유방암 치료제 '파이로티닙' 2차→3차 치료제 임상 변경
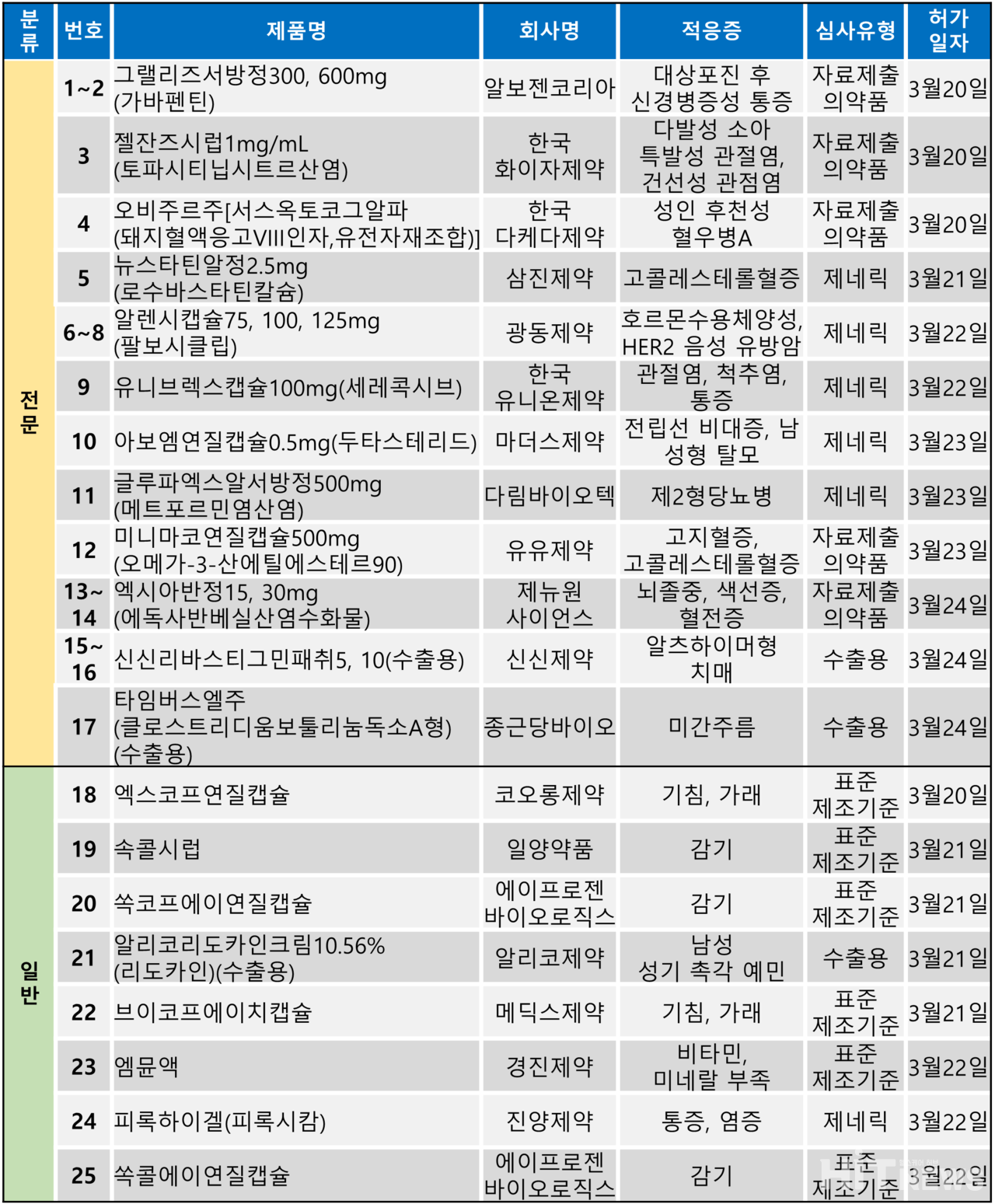
지난주(3월 20~24일)에는 총 25개 품목이 식품의약품안전처로부터 품목허가를 받았다. 이 중 전문의약품은 17건, 일반의약품은 8건이었다.
허가 품목들은 제2형당뇨병, 다발성 소아 관절염, 혈우병A, 고콜레스테롤혈증, 알츠하이머형 치매 등 다양한 질환을 대상으로 승인됐다.
한국화이자가 개발한 소아 관절염 치료제 '젤잔즈시럽(성분 토파시티닙)'이 지난 20일 허가됐다. 토파시티닙은 JAK(야누스키나아제) 억제제의 일종으로 면역 및 염증 반응을 조절하는 면역억제제다.
식약처는 젤잔즈시럽을 '다발성 소아 특발성 관절염(pJIA) 및 소아 건선성 관절염(jPsA)'을 적응증으로, 만 2세 이상 만 18세 미만 소아, 청소년을 대상으로 허가했다.
현재 회사는 정제 형태의 젤잔즈정과 젤잔즈XR 서방정 품목을 보유하고 있다. 허가 적응증은 △류마티스관절염 △건선성 관절염 △강직성 척추염 △궤양성 대장염 등이며, 젤잔즈정만이 젤잔즈시럽과 같이 다발성 소아 특발성 관절염 및 소아 건선성 관절염 적응증을 보유하고 있다.
회사 관계자에 따르면, 이번 시럽 제형 개발 이유는 소아들이 알약 복용에 어려움을 느끼는 것에 대한 복약 편의성 측면인 것으로 나타났다.
또한 젤잔즈정은 최소 용량 단위가 5mg인 정제다. 40kg 이상인 소아는 5mg 제제를 1일 2회 투여하면 되는 반면, 20kg 이상 40kg 미만 소아는 1일 2회, 10kg 이상 20kg 미만 소아는 1일 2회 3.2mg 등을 복용해야 했기에 경구 용액으로 조제 복용해야 하는 어려움이 있었다.
시럽제제 허가로 이런 어려움들이 일부 해소될 것으로 전망되며, 다른 적응증으로의 확대는 계획된 바 없는 것으로 확인됐다.
한편 젤잔즈시럽은 미국 FDA 2020년 9월, 유럽 EMA 2021년 8월에 허가 및 사용되고 있다. 다만, 아직 일본에는 허가되지 않았다.
한국다케다제약이 개발한 후천성 혈우병A 환자 출혈 치료제 희귀의약품 '오비주르주(성분 서스옥토코그알파)'가 20일 허가됐다.
후천성 혈우병A 환자는 정상적인 혈액 응고 Ⅷ인자를 가지고 있지만, 혈액응고 Ⅷ인자에 특이적으로 결합하는 중화항체가 혈액 응고를 방해해 출혈 시 지혈이 어렵다.
오비주르는 돼지 혈액응고 Ⅷ인자의 유전자 염기서열을 이용해 혈액응고에 필요하지 않은 부분은 유전자재조합 기술로 제거해 제조한 혈액응고 Ⅷ인자다. 이 의약품은 중화항체로 인해 억제된 혈액응고 Ⅷ 인자를 일시적으로 대체해 혈우병A 환자의 지혈에 도움을 준다.
후천성 혈우병A는 현재까지 총 12가지 혈액 응고 인자가 관여하는 것으로 알려져 있다. 선천성 혈우병A는 Ⅷ인자 결핍, 혈우병B는 Ⅸ인자 결핍, 혈우병C는 Ⅺ인자 결핍 등이 원인이다.
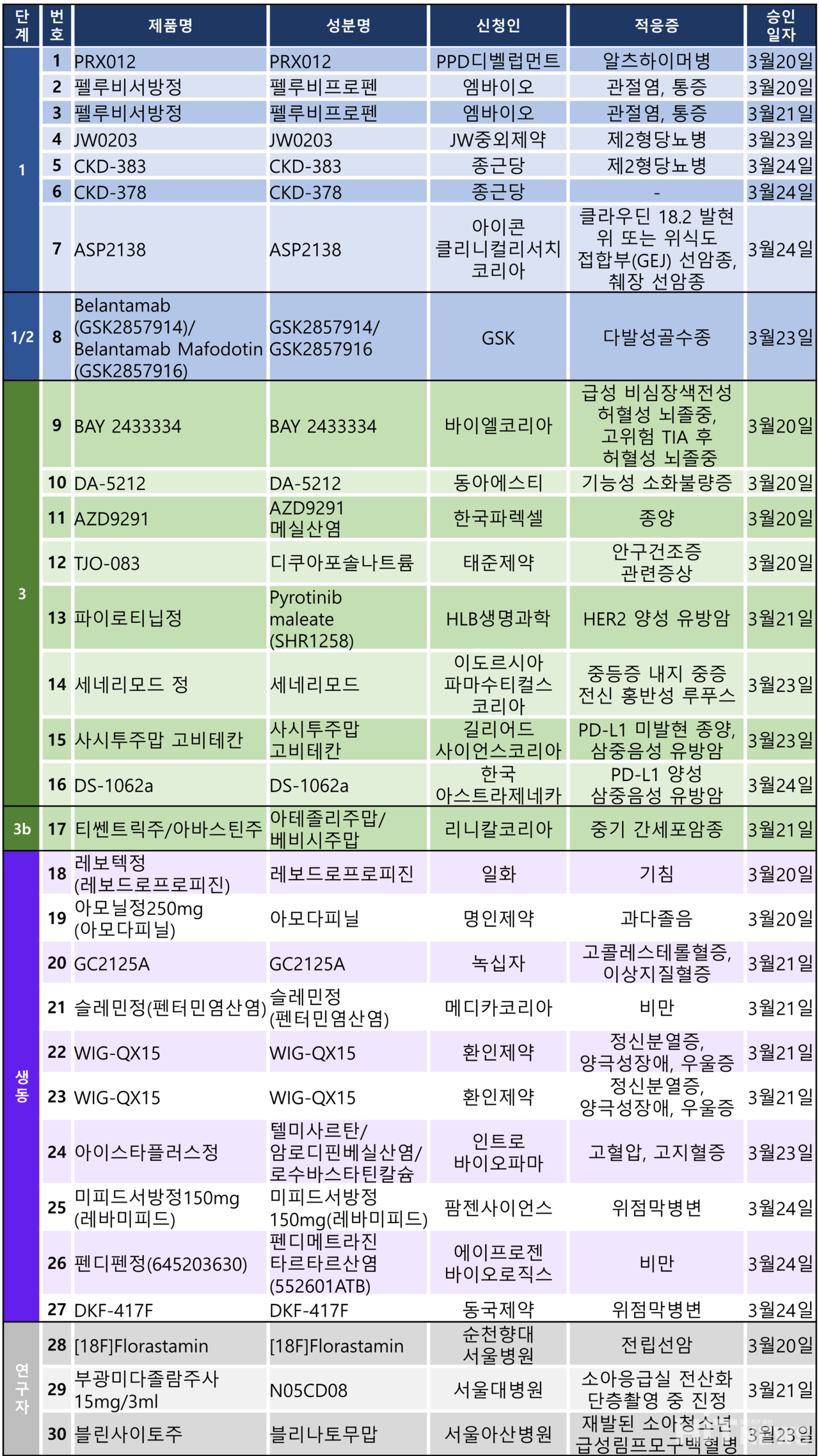
지난주 임상시험계획은 총 30건이 승인 완료됐다. 세부적으로 △1상 7건 △1/2상 1건 △3상 8건 △3b상 1건 △생물학적동등성 10건 △연구자임상 3건 등이다.
이 임상시험들은 알츠하이머병, 관절염, 제2형당뇨병, 다발성골수종, 뇌졸중 등 질환과 유방암, 간세포암종 등 암종을 대상으로 승인됐다.
HLB생명과학이 중국 항서제약에서 도입해 개발중인 HER2(사람상피세포성장인자수용체2형) 양성 유방암 치료제 '파이로티닙'의 임상3상 시험 계획이 21일 식약처로부터 승인됐다. 파이로티닙은 EGFR(상피세포성장인자수용체), HER2, HER4(사람상피세포성장인자수용체4형)를 타깃으로 하는 경구용 표적항암제다.
사실 HLB생명과학은 식약처에 작년 7월 파이로티닙+카페시타빈 등 동일 제제 비교 임상시험계획을 신청한 바 있다. 당시 회사 측은 '트라스투주맙, 탁산계 또는 안트라시클린계 약물 치료 경험이 있는 HER2 양성 전이성 또는 재발성 유방암 환자'를 대상으로 하는 2차 치료제로 임상시험 계획을 신청했다.
이번 임상시험은 'HER2 양성 전이성 또는 재발성 유방암에 대한 이전 치료로써 HER2 항암요법으로 2차 요법까지 실패 또는 불응한 환자'를 대상으로 파이로티닙+카페시타빈 병용요법과 라파티닙+카페시타빈 병용요법의 안전성과 유효성을 비교한다. 즉, 3차 치료제로 임상 시험 방향을 튼 것이다. 임상시험 대상도 58명에서 204명으로, 임상기관도 10곳에서 12곳으로 확대했다.
회사는 이번 임상의 일차 유효성 평가변수를 무진행 생존기간(PFS), 이차 유효성 평가변수를 △전체생존기간(OS) △객관적 반응률(ORR) △반응지속기간(DoR) △질병 진행까지 시간(TTP) △임상적 유효율(CBR) 등으로 설정했다.
임상은 △고려대의대부속병원 △고려대의대부속 구로병원 △충북대병원 △중앙대병원 △이화여대의대부속 목동병원 △연세대의대 세브란스병원 △가톨릭대 서울성모병원 △삼성서울병원 △분당서울대병원 △국립암센터 △길병원 △서울대병원 등 12곳에서 진행된다.
한편 파이로티닙은 2020년 중국에서 카페시타빈과의 병용요법으로 트라스투주맙(캐싸일라) 치료 경험 여부와 상관없이 HER2 양성 전이성 유방암 2차 치료제로 승인을 받은 바 있다.

