복지부·심평원, 10일 약제 상한금액 설명회 진행
급여적정성 재평가 성분 이달 약평위에서 심의

이달 약제 기준요건 상한금액 재평가 자료제출이 마무리되면 급여적정성 재평가가 진행될 전망이다. 재평가가 쉴틈없이 이어지고 있다.
보건복지부와 건강보험심사평가원은 오는 10일 제약사들을 대상으로 '기등재 의약품 상한금액(기준요건) 재평가 설명회'를 진행한다.
지난 2020년 시행된 제네릭 의약품 약가제도 개편 이후 의약품 재평가 유예기간 종료가 다가옴에 따라 제도의 정확한 이해 제고 등 제약사의 업무 효율성을 증대시키겠다는 취지다.
1차 평가대상 1만5000여개 약제에 대한 자료제출 마감기한은 이번 달 28일까지며, 3년 전 재평가를 공고한만큼 특별한 이유가 없는 한 유예는 없을 것으로 예상된다.
이번 자료제출이 마무리되면 '급여적정성 재평가'가 기다린다.
심평원은 오는 9일 약제급여평가위원회에서 2023년 약제 급여적정성 재평가 성분을 심의한다.
재평가 대상 성분은 작년에 이미 공개된 상태로, △소화성궤양용제 레바미피드 △순환계용약 오팔몬 △해열진통소염제 록소프로펜나트륨 △소화기관용약 레보설피리드 △알레르기용약 에피나스틴 △안과용제 히알루론산 점안제 6개 성분이다.
임상재평가에서 효과 입증에 실패한 중추신경계용약 아세틸엘카르니틴염산염과 옥시라세탐은 제외된다.
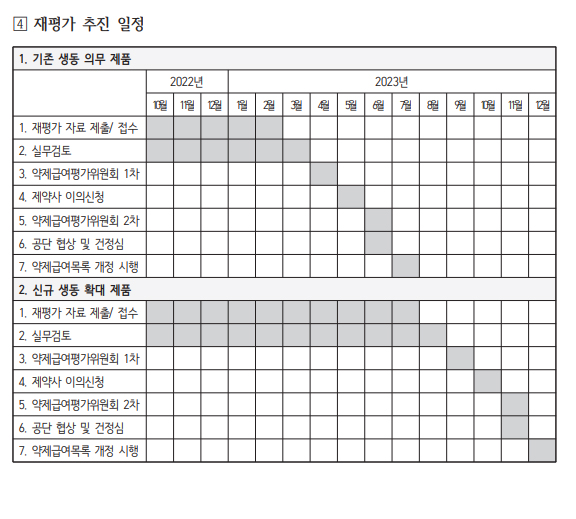
작년 급여적정성 재평가 일정을 보면, 올해 스케줄이 예측가능하다.

작년 2월 약평위에서 급여적정성 재평가 성분을 심의했고, 건강보험정책심의위원회를 거쳐 3월 재평가가 공고됐다.
해당 성분을 보유한 회사들은 4월 초까지 임상적 유용성을 입증할 수 있는 자료를 제출했다.
5월까지 실무검토와 전문가 회의를 진행하고, 6월 약제사후평가소위원회와 7월 약평위 심의를 거쳐 평가결과를 제약사에 통보했다. 제약사들은 결과에 때해 30일간(8월) 이의신청을 했고, 또다시 실무검토와 소위원회, 10월 약평위 심의를 거쳐, 11월 품질관리 협상(급여유지 또는 급여기준 변경약제 대상), 12월 1일자로 재평가 결과가 반영됐다.
이 같은 일정대로라면 급여적정성 재평가와 약제 상한금액 재평가(1차, 2차)가 쉴틈없이 진행될 것으로 보인다.

