27일 기준, 총 331건의 의약품 회수명령 집계
안정성시험에 따른 품질부적합, 허가사항과 다르게 제조 등 대표적
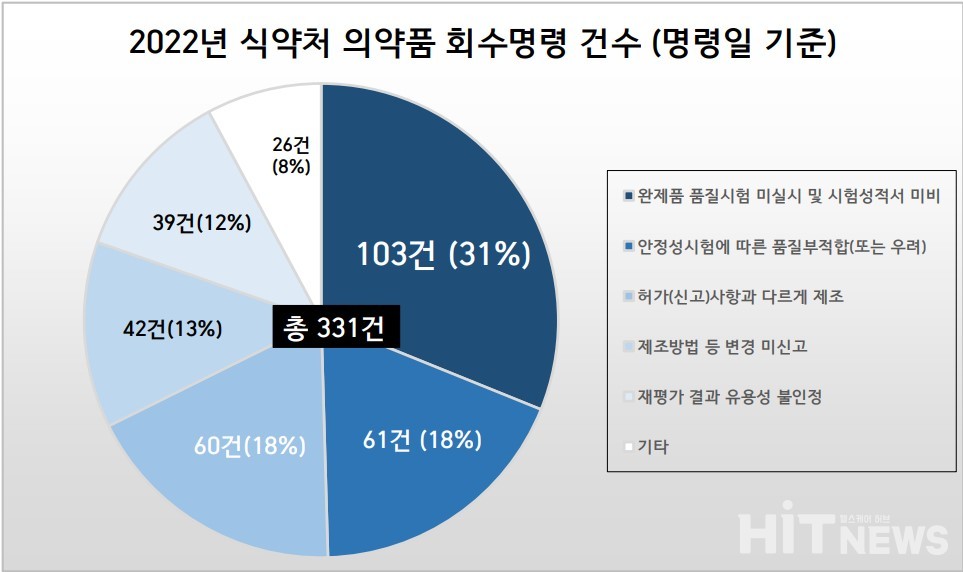
'완제 의약품의 품질시험 미실시 및 시험성적서 미비'가 올해 의약품 회수폐기 명령 중 최다 건수를 차지했다.
히트뉴스가 식품의약품안전처가 공개한 의약품 회수폐기 명령 내역(한약재 및 원생약 제외)을 분석한 결과, 27일 기준 총 331건의 의약품 회수 명령이 있었다.
전체 회수 명령은 △완제품 품질시험 미실시 및 시험성적서 미비(103건, 31%) △안정성시험에 따른 품질부적합(또는 우려)(61건, 18%) △허가(신고)사항과 다르게 제조(60건, 18%) △제조방법 등 변경 미신고(42건, 13%) △재평가 결과 유용성 불인정(39건, 12%) △기타(26건, 8%) 등 순으로 분류할 수 있었다.
가장 많은 사유는 '완제품 품질시험 미실시 및 시험성적서 미비'였다.
모두 '한국신텍스제약'에서 제조된 한약제제였으며, 회사는 지난 1월 1일을 시작으로 지난 7월 1일까지 총 103건의 회수명령을 받았다.
'안정성시험에 따른 품질부적합(또는 우려)'도 61건으로 그 뒤를 이었다. 다만, 안정성시험에 따른 품질 부적합 사유는 △불순물의 (초과)검출 △유연물질 기준 초과 △pH 부적합 등 다양했으나, 업체별로 세부 사항이 비공개된 경우가 있어 구체적 통계는 불가했다.
불순물 검출 성분으로는 N-nitroso Salbutamol, NDMA(N-Nitrosodimethylamine), NMOR(N-Nitrosomorpholine), NNAP(N-nitroso-Aryl Piperazine quetiapine) 등이 대표적이었다.
'아세틸-L-카르니틴염산염' 성분 제제의 임상 재평가 실패도 주요 회수 사유로 확인됐다.
뇌기능개선제로 사용되는 이 성분 제제들은 임상시험 재평가에서 임상적 유용성을 입증하지 못해 지난 9월 회수명령을 받았다. 조치 대상은 35개 제조사, 39개 품목이었으며, 당시 회수를 앞두고 한미약품이 동 성분 제제 취급 업체들을 대표해 이의신청했으나 결국 받아들여지지 않았다.
이 외 기타 사유로는 △표시기재 누락 또는 오류 △약사법 위반(국가출하승인)에 따른 품목허가 취소 △낱알식별오류 △이물혼입 △타 제품 혼입 △동봉된 의료기기 밀봉 불량 등이 존재했다.
이 중 '약사법 위반에 따른 품목허가 취소'에 해당하는 제품은 '제테마 제테마더톡신주100U(수출용)', '한국비엠아이 하이톡스주100단위(수출용)', '한국비엔씨 비에녹스주(수출용)' 등 3개 수출용 보툴리눔톡신 제제로 나타났다.
이 제품들은 지난 11월 국가출하승인 없이 국내에 판매된 점이 식약처로부터 적발되면서 회수명령이 내려졌으며, 식약당국-회사간 법적공방이 이뤄지고 있는 가운데 지난 16일 품목허가 취소 처리됐다.

