식약처, 자사제조 10품목·수탁제조 33품목 대상 조치
변경허가 받지 않고 첨가제 임의 사용 등 약사법 위반 확인

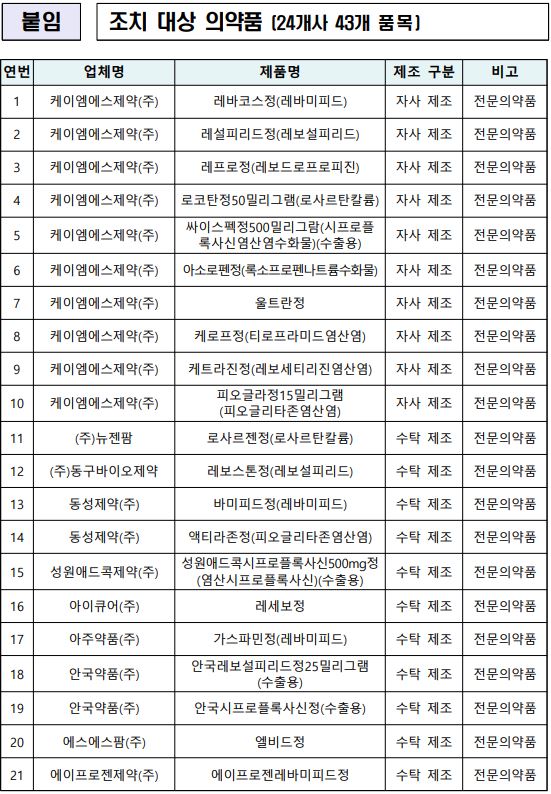
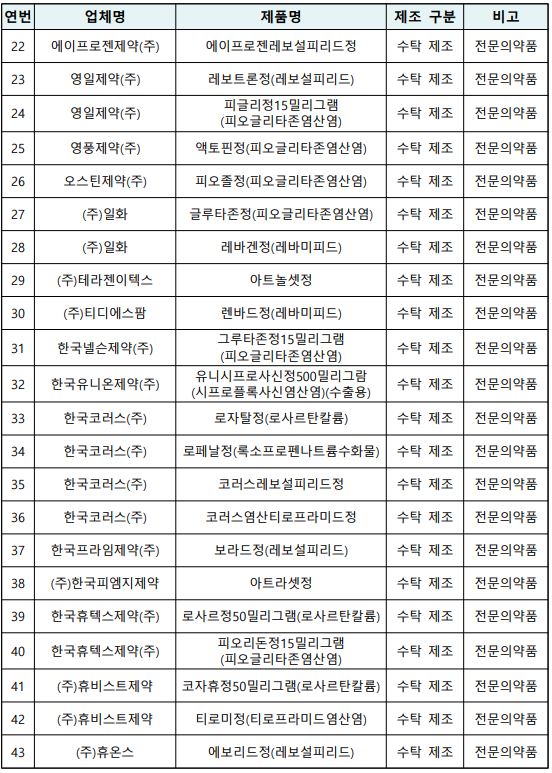
식품의약품안전처가 케이엠에스제약에서 제조한 위궤양치료제 '레바코스정' 등 43개 품목에 대해 잠정 제조·판매 중지하고 회수 조치한다. 대상은 자사제조 10개, 수탁제조 33개 품목이다.
오정원 의약품안전국 의약품관리과 과장은 "이번 조치는 케이엠에스제약에 대한 현장점검 결과 △변경허가·신고를 받지 않고 첨가제 임의 사용 △제조기록서 거짓 작성 등 의약품 제조·품질관리 기준(GMP)을 위반한 것에 따른 조치"라고 밝혔다.
식약처는 이번 조치 대상품목을 복용 중인 환자는 의료전문가와 상의해 대체 의약품으로 전환하도록 권고하고, 의사·약사·소비자 단체 등에 관련 제품 회수 협조를 요청하는 내용의 '의약품 안전성 속보'를 배포했다.
또한 보건복지부와 건강보험심사평가원에 병·의원과 약국이 해당 품목을 처방·조제할 수 없도록 조치를 요청했다.
오정원 과장은 "이번 GMP 위반 적발은 일부 제약업체의 고의적 일탈행위를 근절하기 위해 올해부터 운영 중인 'GMP 위반 우려 업체 대상 무통보 점검'으로 적발한 사례"라며 "지난해부터 운영 중인 ‘의약품 제조‧품질 불법행위 클린 신고센터’와 올해 12월 시행 예정인 'GMP 적합판정 취소제' 등 제도를 바탕으로 의약품 제조소에 대한 현장점검을 지속적으로 실시해 안전하고 고품질의 의약품이 국내에 공급되도록 적극 노력하겠다"고 말했다.
한편, 식약처가 올해 12월 시행 예정인 GMP 적합판정 취소제는 GMP 적합판정을 거짓·부정하게 받거나 반복적으로 GMP 기록을 거짓으로 작성한 경우 GMP 적합판정을 취소하는 제도다.