한국릴리 제2형 당뇨병 치료제로 개발... 비만으로 적응증 확대 중
한국얀센, 다발성경화증 2차 치료제로 1일1회 경구제 폰보리 허가

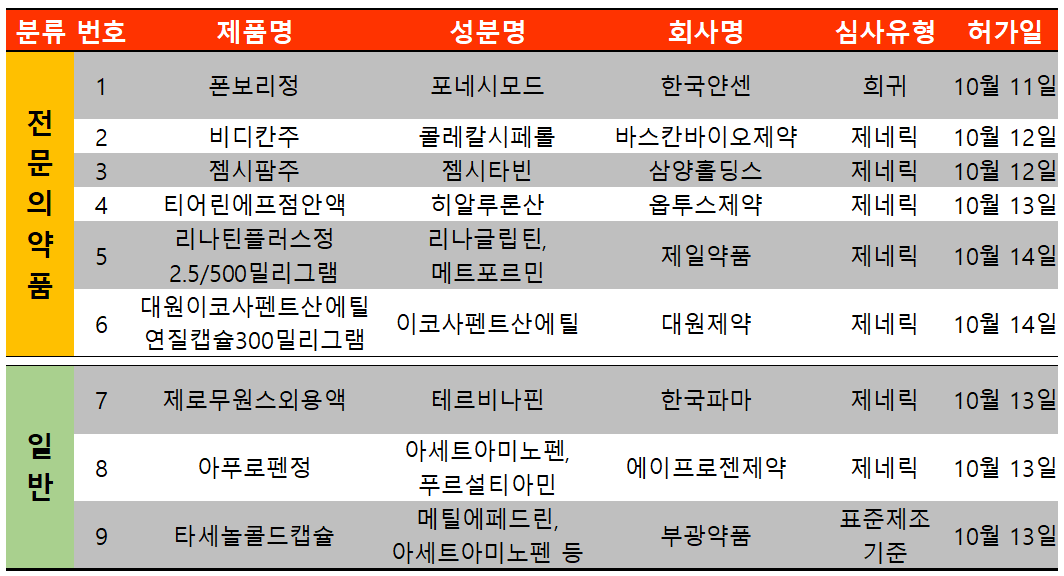
지난 주(10월 11일~10월 16일) 9개 품목이 식품의약품안전처에서 허가받았다. 전문의약품은 6건, 일반의약품은 3건이었다.
한국 얀센 다발성경화증 치료제 폰보리(성분 포네시모드)가 드디어 국내 허가받았다. FDA는 폰보리는 지난 2021년 3월 허가를 했고 EU는 2021년 5월 허가했다.
다발성경화증 치료제는 피하주사제와 경구제로 나뉘며 폰보리의 경우 1일 1회 복용하면돼 약물순응도가 높다.
식약처는 성인의 재발 이장성 다발성경화증 치료로 허가했으며 국내 유사 적응증으로 허가된 성분은 테리플루노마이드 등 총 11개 성분이 존재한다.
폰보리는 림프구가 림프 기관에서 분리되는 것을 차단해 말초혈액 중 림프구 수가 신속하게 감소되도록 유도함으로써 염증성 반응을 줄여주는 기전으로 작용한다.
다발성경화증은 모든 연령층에서 발생할 수 있지만, 주로 20~40세에 가장 많이 발생하고, 10세 이전이나 60세 이후에는 발병이 드물다. 남성보다 여성에게 2배 정도 많이 발생하는 편이다.
우리나라에서는 10만 명당 4명 정도로 발병률이 낮지만 미국이나 유럽에서는 10만 명당 100명 정도의 유병률을 가진다.
앞으로 폰보리가 경쟁할 제품으로는 한국머크의 마벤클라드(성분 클라드리빈)다. 마벤클라드는 급여 등재도 이미 2년이 지난 만큼 현장에서 임상경험을 쌓고 있어 향후 폰보리가 어떻게 이같은 시장 상황을 타개할 지 주목된다.
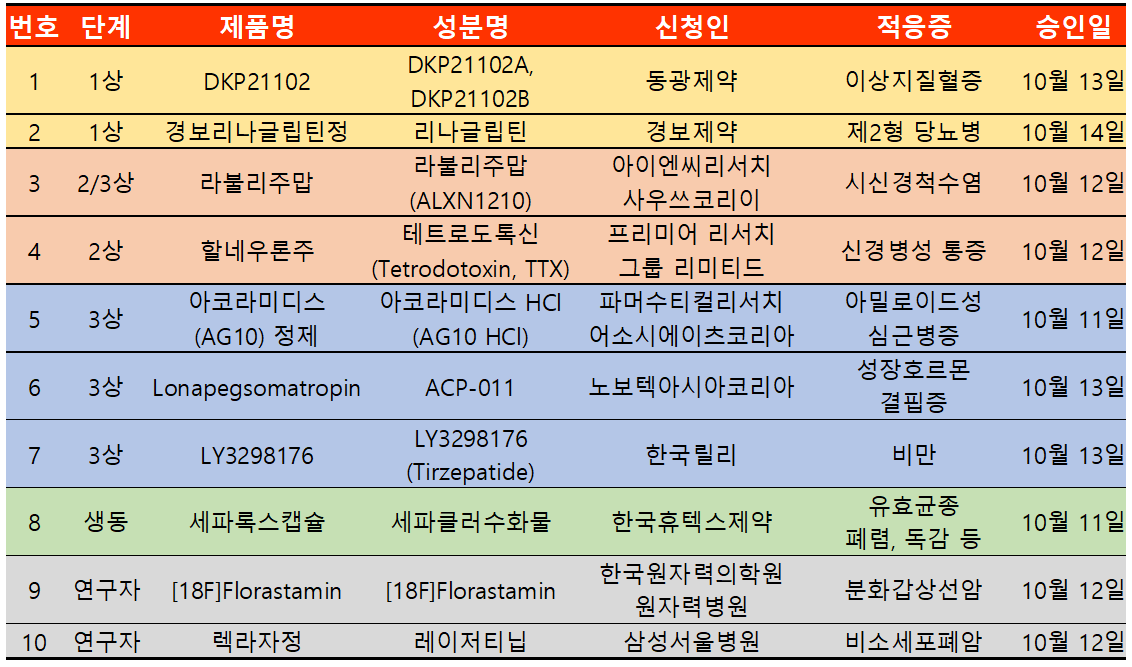
지난 주 임상시험계획은 총 10건이 승인됐다. 임상1상 2건, 2상 2건, 3상 3건, 생동 1건, 연구자 2건 등이다.
릴리의 제2형 당뇨병 치료제로 개발한 신약 LY3298176(성분 티제파티드) 상품명으로는 마운자로가 식품의약품안전처로부터 비만과 과체중 질환에 대해 임상 3상에 대한 승인을 받았다.
마운자로는 제2형 당뇨병 치료제로 체중 감량과 혈당 조절의 효과가 임상시험 결과를 통해 입증됐으나 체중 감량 부분에서 효과가 월등히 높아 비만치료제로 적응증 확대를 위한 추가적인 임상 시험을 진행 중이다.
이번 승인은 비만 성인에서 이환율 및 사망률 감소에 대한 터제파타이드의 영향을 연구하기 위한 제 3상 시험으로 다국가시험이며 전체 시험대상자수는 1만 5000명이며 국내에서는 60명이 참여할 예정이다.
마운자로는 동종계열 최초로 GLP-1과 GIP 수용체들을 활성화시켜 혈당 수치의 조절을 개선하는 치료제로 혈당 수치의 조절을 충족하고 내약성이 확보되는 용량으로 조절하면서 주 1회 피하주사제로 투여하는 약물이다.
마운자로는 당뇨 치료제만으로도 차기 5년 내 연간 매출 10억 달러를 넘을 블록버스터 신약으로 거론되는 약이다.
정보 분석 서비스 기업인 클래리베이트는 마운자로의 2026년 예상 매출액을 45억 5000만 달러로 예측했으나 이는 당뇨병 치료제만을 고려한 금액인 만큼 비만 치료제로까지 허가가 이어진다면 매출액은 더욱 커질 전망이다.

