식약처 의약품 허가 및 임상승인 주간 현황 (9월5일~12일)

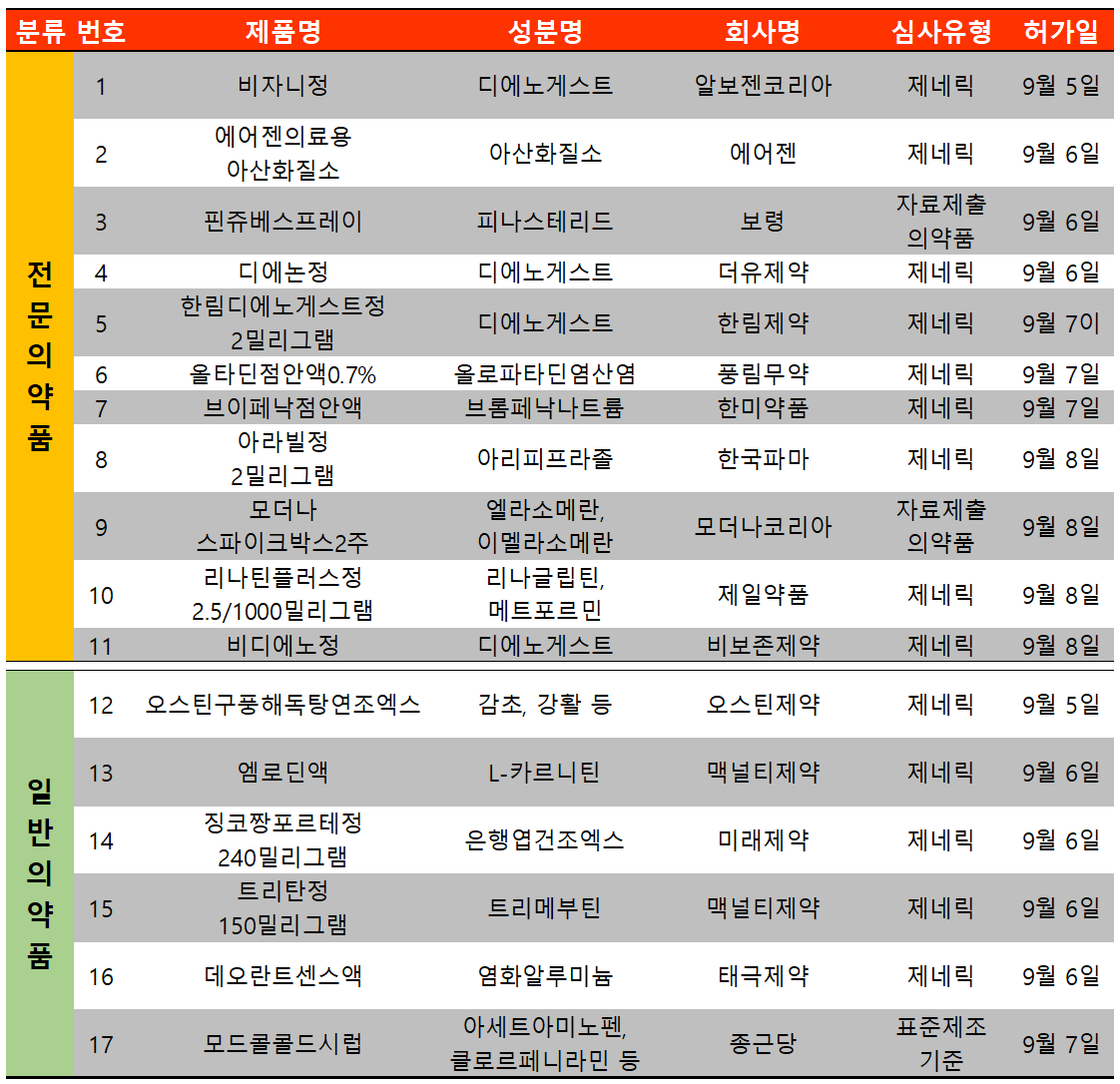
지난 주(9월 5일~9월 12일) 17개 품목이 식품의약품안전처에서 허가받았다. 전문의약품은 11건, 일반의약품은 6건이었다.
자궁내막증 치료제인 디에노게스트 성분 제제의 허가가 이어졌다. 알보젠코리아 비자니(성분 디에노게스트)가 9월 5일 허가된 후 6일 더유제약 디에논(성분 디에노게스트), 7일 한림제약 한림디에노게스트정(성분 디에노게스트), 8일 비보존제약 비디에노(성분 디에노게스트)까지 허가됐다.
이 4개 품목 모두 8월 30일 허가받은 지엘파마 지엘디에노게스트(성분 디에노게스트)의 위수탁 품목으로 지엘파마에서 위수탁 생산을 할 예정이다.
디에노게스트 성분제제는 지엘파마의 허가 이전에는 팜비오 유엔(성분 디에노게스트) 제네릭 품목 외에는 미분화 제제만 허가됐었다. 현재 디에노게스트 허가 품목은 전체 11개이다.
디에노게스트 제제의 오리지널 의약품은 바이엘의 비잔(성분 디에노게스트)으로 2011년 7월 허가받았다.
유비스트 통계에 따르면 2019년 기준 디에노게스트 제제 원외처방 매출액은 85억 원이었으며 2020 81억 원으로 조금 낮아진 후 2021년 다시 97억 원으로 상승했다.
자궁내막증 환자는 최근 5년간 48.2% 증가했으며 연평균 증가율은 10.3%를 보여 디에노게스트 시장규모는 계속 커질 전망이다.
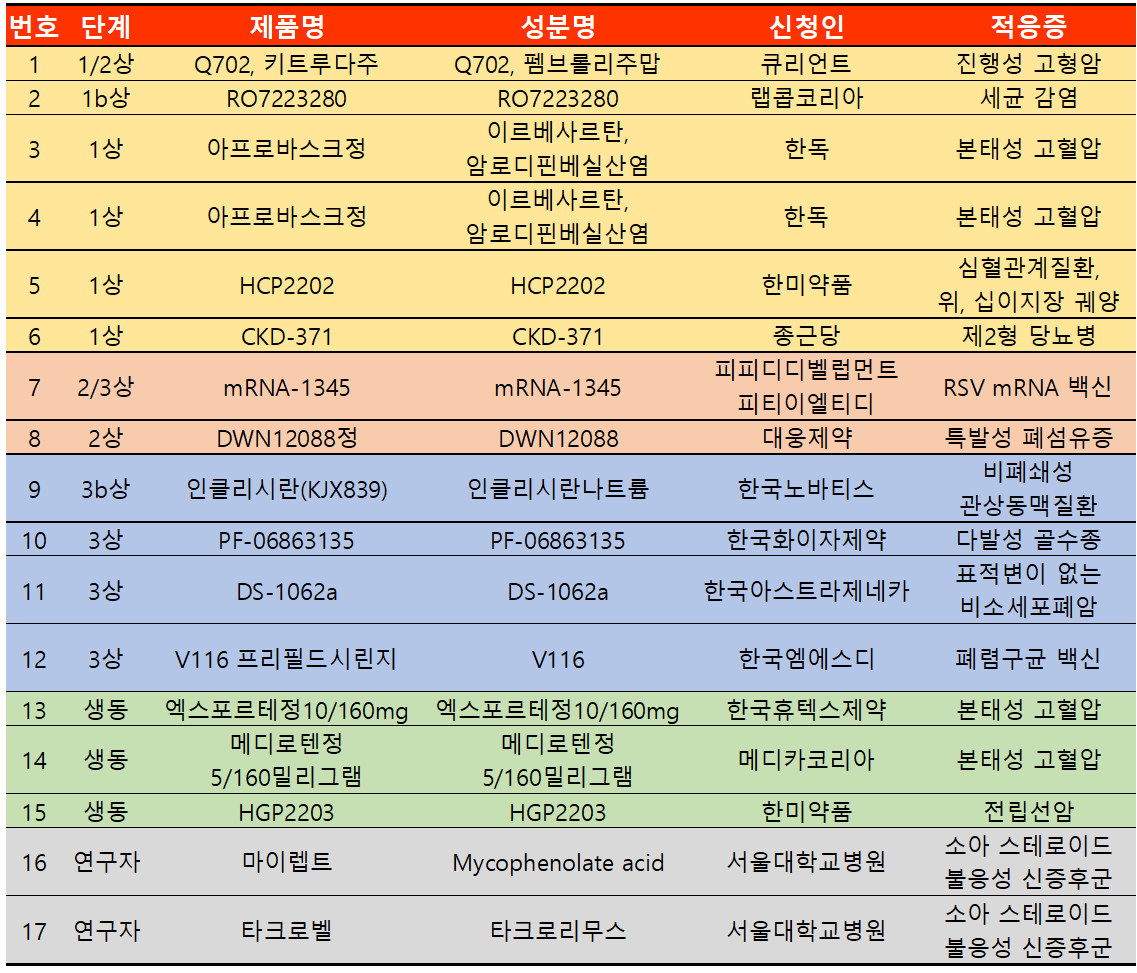
지난 주 임상시험계획은 총 17건이 승인됐다. 임상1상 6건, 2상 2건, 3상 4건, 생동 3건, 연구자 2건 등이다.
글로벌 제약사가 자사의 신약 품목에 대한 근거 확보를 위해 다양한 임상 내용을 바탕으로 다각화 중이다.
한국화이자제약은 다발성 골수종 치료제로 'PF-06863135' 제품 3상 임상시험을 승인받았다. 해당 승인은 다발성 골수종을 새로 진단받은 이식 부적합 시험대상자를 대상으로 엘라나타맙(PF-06863135) + 다라투무맙 + 레날리도마이드의 유효성 및 안전성을 다라투무맙 + 레날리도마이드 + 덱사메타손과 비교해 평가하기 위한 공개임상이다. 다국가로 진행되며 전체 시험대상자 수는 606명이며 국내 대상자 수는 4명이다.
PF-06863135는 지난 2월 이미 자가 조혈모세포 이식을 받은 후 미세잔존질환 양성인 새로 진단된 다발성 골수종 환자를 대상으로 레날리도마이드)대비 엘라나타맙의 유효성과 안전성을 비교 평가시험을 승인 받았다.
이와 비교해 이번 승인은 다발성 골수종 1차 치료 중 조혈모세포 이식이 어려운 환자 대상으로 다라투무맙 및 레날리도마이드의 병용요법을 대비해 임상 결과에 따라 사용 범위의 차이가 발생할 수 있다.
한국아스트라제네카의 경우 'DS-1062a'(성분 다토포타맙 데룩스테칸)에 대해 3상 임상승인을 받았다. 해당 승인은 표적화가능한 게놈 변화가 없는 국소 진행성 또는 전이성 NSCLC 환자의 1차 선택 치료로서 다토포타맙(Dato-DXd)+더발루맙+카보플라틴 병용투여를 펨브롤리주맙+백금 기반 화학요법 병용투여와 비교 평가하는 임상이다. 다국가로 진행되며 전체 시험대상자 수는 1000명이며 국내 대상자 수는 41명이다.
DS-1062a는 아스트라제네카뿐만 아니라 다이이찌산쿄가 함께 개발중인 의약품으로 총 7건의 임상시험을 승인받았다. 지난 2021년 2월 2차 치료제로 변이 유전자가 없는 NSCLC에 대해 도세탁셀 대비 승인받았으며 이후 2022년 2월에는 변이 유전자가 없는 NSCLC에 대해 PD-L1 고발현 대상 환자에 대해 승인받았다.
아스트라제네카는 항체-약물접합체(ADC)인 엔허투(성분 트라스투주맙 데룩스테칸)의 성공적인 개발 이후 DS-1062a를 이어 개발중이며 타그리소(성분 오시머티닙) 등 이미 폐암 분야에서 다양한 포트폴리오를 구축 중이다.

