식약처, 체외진단의료기기 허가·신고 등에 관한 규정 일부개정고시(안)
기허가 코로나19 체외진단의료기기가 자가검사키트로 허가·승인을 변경할 수 있는 행정기준이 마련될 전망이다.
식품의약품안전처는 허가를 받은 체외진단의료기기 중 사용목적, 사용방법 등을 변경한 체외진단의료기기의 시판 후 자료제출할 수 있도록 하는 '체외진단의료기기 허가·신고·심사 등에 관한 규정 일부개정고시(안)'을 13일 행정예고했다.
현행 규정에 따르면 국내 허가를 획득한 코로나19 관련 체외진단의료기기 사용자는 의료인으로 국한돼 왔다.
개정고시를 통해 식약처는 코로나19 관련 체외진단의료기기 사용자를 비전문인으로 변경해 출시돼 있는 진단키트들이 허가사항 변경을 통한 개인 사용을 가능하도록 했다.
다만 개인용으로 허가사항이 변경돼 출시되는 새 품목들은 진단기능보다는 코로나19 확진자 선별을 위한 보조적 수단으로 사용한다는 것이 식약처 입장이다.
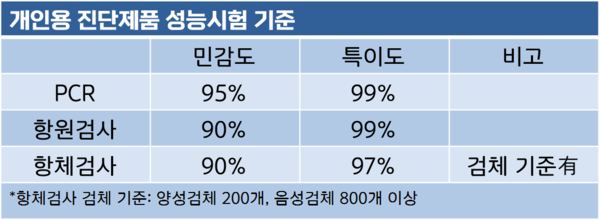
식약처는 개인용 코로나19 진단시약 허가·심사기준을 지난달 공개하면서 개인용 검사제품에 대한 사용·성능 기준을 마련한 바 있다. 최근 정례브리핑을 통해서도 방역현장 보조적 수단으로 활용될 자가검사키트 사용 가능성을 언급해 왔다.
이번 개정고시안을 통해 식약처는 기존 제품의 허가 변경을 통한 개인용검사키트 진입 가능성을 열어두겠다는 입장이다.
식약처 관계자는 "사용자를 포함한 사용방법 변경 기준 개정고시안 목적에는 개인용 검사키트 허가·승인을 위한 제도 마련도 포함돼 있다"며 "진단법으로 인정하기에는 무리가 있으나, 선별을 목적으로 수행하는 보조적 검사법이라는 측면에서 자가검사키트 사용 필요성은 충분하다"고 설명했다.
한편, 식약처 브리핑과 업계에 따르면 현재 5개 업체에서 자가검사키트 개발을 검토하고 있으며, 일부 업체에서는 자가검사키트 임상시험을 진행 하고 있는 것으로 확인됐다.
업계 관계자는 "개인용 진단검사제품 허가 가이드라인에 따라 수출 품목으로 승인받은 신속항원진단키트 품목에 대한 국내 임상을 진행하고 있다"며 "임상적 민감도, 특이도 데이터 확보 후 승인 절차를 밟을 것"이라고 설명했다.