연구자주도 임상은 복지부, 허가용 임상은 식약처 주도
복지부 재생의료기관, 식약처 세포처리시설 관리
"기허가 의약품에 대한 리베이트 악용 가능성 있어"
지난해 8월 시행된 첨바법에 따라 학술목적의 연구자 주도 임상시험은 보건복지부, 상업화를 위한 허가 임상은 식품의약품안전처가 관리하는 등 이원화 된 체계로 관리된다.
최정윤 씨엔알리서치(C&R Reserach) 이사는 '세포치료제 임상시험'을 주제로 베스티안재단 주관 10일 온라인으로 열린 제 1회 바이오혁신 세미나에서 발표하며 첨단재생의료 및 첨단바이오의약품 안전 및 지원에 관한 법률 시행령(첨바법)으로 바뀐 제도를 설명했다.
![[출처=제 1회 바이오혁신 세미나 발표 슬라이드]](https://cdn.hitnews.co.kr/news/photo/202103/33183_35223_5540.jpg)
최 이사는 "현행 품목허가를 위한 임상은 식약처 관리 아래에 있기 때문에, 식약처 품목허가 트랙을 그대로 따르면 된다"며 "개정된 첨바법은 학술목적 임상시험에 대해서 복지부 트랙에 따라 현 임상시험 체계에서 관리받게 된다"고 설명했다.
이어 "보유하고 있는 첨단바이오의약품 후보물질이나 파이프라인 중 희귀질환, 과학적 목적, 넓은 범위에서 학술적 목적의 임상시험을 진행하는 경우 연구자주도 임상으로 분류해 복지부와 함께 임상 계획을 논의해 나가야 할 것"이라고 덧붙였다.
학술 목적으로 첨단바이오의약품 개발을 위한 임상시험을 진행하는 경우 ▷심의위원회 심의 및 승인 ▷재생의료 실시(환자적용) ▷안전관리(모니터링 및 장기추적조사)의 절차로 진행된다. 환자에게 적용하는 첨단재생의료 실시기관은 보건복지부장관이 지정한다.
지난 4일 기준 복지부가 제 1차 첨단재생의료실시기관으로 지정한 곳은 ▷건국대학병원 ▷경희대학교병원 ▷고려대학교의과대학부속 구로병원 ▷고려대학교의과대학부속 안산병원 ▷단국대학교의과대학부속병원 ▷동아대학교병원 ▷분당서울대학교병원 ▷서울대학교병원 ▷순천향대학교부속부천병원 ▷순천향대학교부속천안병원 ▷연세대학교의과대학 강남세브란스병원 ▷의료법인 길의료재단 길병원 ▷인하대학교의과대학부속병원 ▷서울아산병원 ▷전담대학교병원 ▷충남대학교병원 ▷고려대학교의과대학부속병원 안암병원 ▷가톨릭대학교 서울성모병원 ▷연세대학교의과대학 세브란스병원 ▷한림대학교성심병원이다.
복지부 주도 학술목적 임상연구 관리 체계를 살펴보면, 세포처리시설 외에는 복지부와 국립보건연구원이 임상연구 전반을 관리하게 된다. 복지부는 재생의료기관을 지정할 뿐만 아니라, 심의위원회를 열어 임상연구의 적합여부도 심의한다.
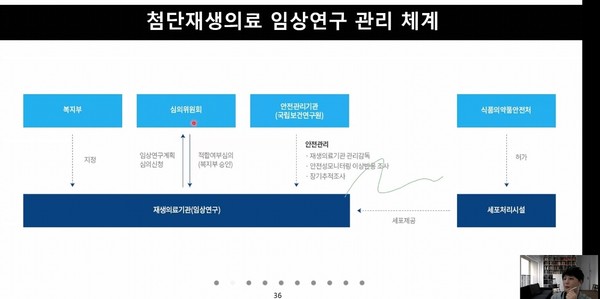
여기에 국립보건연구원은 임상연구의 안전관리기관으로 지정됐다. 이에 따라 국립보건연구원은 ▷재생의료기관 관리감독 ▷안전성모니터링 이상반응 조사 ▷장기추적조사를 맡게 된다. 이때 사용되는 세포치료제 후보물질 임상시료 및 세포는 식약처가 허가한 세포처리시설에서 제조돼야 한다.
그는 "허가용이나 연구용 임상 모두 세포치료제 후보물질의 잠재적 위험성(종양원성 등) 관련 문서는 스폰서 차원의 철저한 관리가 필요하다"고 조언했다.
세포치료제 업계 관계자는 이와 같은 복지부와 식약처로 이원화 된 임상관리 체계에 대해 개발 업체 입장에서 다소 혼선이 일어날 수 있다는 의견을 제시했다.
업계 관계자는 히트뉴스에 "상용화를 지향하는 회사의 경우, 기본적으로는 상업화임상(SIT)을 목표로 하므로 달라진 것이 없다"며 "오히려 기허가 제품이 있는 중견기업의 경우에는 영업을 위해 합법적인 리베이트 목적으로 연구자임상(IIT) 제도를 잘 이용할 수도 있다"고 말했다.
이어 "개발 중인 벤처기업은 상용화 제품으로 임상을 하지 않고, 연구자 임상(SIT)만 진행하는 꼼수를 부릴수도 있다"며 "임상 진행중이라고 투자받고 사업을 하는 경우가 발생할 수 있다"고 덧붙였다.
이 관계자는 "업계 실무자 입장에선 준비해야 할 자료가 별로 다르지 않은데, 연구주체가 다르다는 이유로 제도가 다른 것은 이해가 안 된다"고 말했다.

