2021년 시행 임박...유럽 시장 생산·수입·유통 전 영역 기준 상향
2017년 5월 유럽에서 발표한 의료기기 규정(Medical Device Regulation, MDR)이 내년 5월 적용을 앞두고 있는 가운데, 유럽 대상 의료기기 수출업체들의 새 인증 획득 준비가 한창이다.
강화되는 분야는 두 개로, 의료기기 지침(Medical Device Directive)과 체외진단의료기기 지침(In Vitro Diagnostic Devices Directive, IVDD)이다. 이들 지침(Directive)은 모두 규정(Regulation)으로 상향되며 법적 지위를 갖게 됐다.
만료기한이 유효한 기존 인증서 보유 업체들은 2024년까지 수출이 가능하다. 다만 기존 MDD 인증기관은 2021년 5월 효력을 상실함에 따라 의료기기 판매 사후관리를 위한 별도 계약은 필요하다.
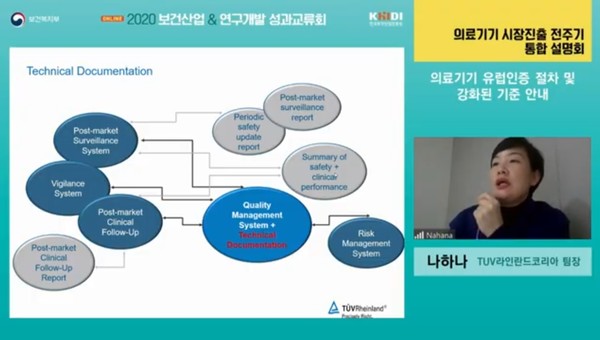
이에 TUV라인란드 코리아 나하나 팀장은 2020 보건산업&연구개발 성과교류회 의료기기 세션에서 MDD에서 MDR 변경점과 주의해야할 사항 들을 소개했다.
TUV 라인란드는 최근 EU로부터 MDR에 이어 IVDR 인증기관으로 지정되기도 했다.
Economic Operator, 품질 책임자등 MDR의 새로운 개념
■ Economic Operator
MDD에서 MDR로 상향되며 도입되는 새로운 개념은 수입자, 유통자, 유럽 대리인이 속하는 Economic Operator 확보다.
이는 제품이 생산되고 유통, 판매되기까지 제품이 어떤 경로로 이동했는지 추적할 수 있도록 만든 개념이다.
수입자는 CE, IFU 등을 확인해야 하고, 불만 관리나 부적합 제품 리콜을 기록하고 관리해야한다. 이때 수입자는 기록된 내용을 제조자 및 유럽 대리인에게 알려야 할 의무가 있다.
또한 이 기록은 의료기기화 함께 제공되는 문서에 반영돼야 하고 수입하는 제품이 EU 의료기기 데이터뱅크 포털 사이트인 EUDAMED에 확인된 제품인지 살펴야 한다.
유통자는 CE, IFU 확인 및 부적합 제품 리콜 등 제조자와 유사한 의무를 지닌다. 관련 사항을 유럽대리인과 수입자에게 알려야 한다.
유럽 대리인은 유럽에 수출을 하고 있는 제조사들이라면 계약·고용돼 있을 사항으로 다만 책임사항이 강화·추가됐다. 제조사의 기술문서가 적절한 절차를 통해 인증 받았는지 확인할 의무 등이다.
유럽 대리인은 기술문서 및 인증서를 관리해야 한다. 또한 해당 의료기기에 대한 법적 책임의무가 생겼을 때 함께 책임 의무를 수행해야 함에 따라 유럽 대리인 신규 계약 시에는 이같은 내용을 확인해야 한다.
특히 수입자, 유통자, 유럽 대리인은 EUDAMED에 모두 등록되고, 이로 인해 유럽 각 국가들은 어떤 과정으로 생산·판매되고 법적 책임 소지자를 판단할 수 있게 됐다.
법적 제조자(Legal manufacturer)의 의무도 추가된다. 법적 제조자는 제품의 생산이나 법적 책임을 지는 사람으로, 우리나라의 제조자와는 개념이 다르다. 유럽은 OEM(위탁생산자)·PLM(제품수명관리자)모두 법적 책임자가 된다.
이들은 기술문서를 작성하고 업데이트해야 하는 의무가 생겼다. 종전 OEM은 기술문서 작성 후 이론적 부분만 PLM 회사에 제공하면 인증기관에서 인증을 내줬지만 MDR적용 이후 부터는 이들모두 기술문서를 작성하고 업데이트 해야 한다.
■ Responsible Person
MDR 하에서는 반드시 최소 한명의 책임자를 지정해야 한다. 이들은 유통 이후 품질 및 시스템이 제대로 돌아가는지 확인해야 한다.
또한 기술문서가 법적 요구사항에 따라 유지되고 업데이트 되고 있는지도 확인할 의무가 있다.
MDR에 따르면 이들은 법약 및 약학 등 전공 졸업자 중 1년 이상의 업계 경력을 보유해야 한다. 학력을 만족하지 못할 경우 4년 이상의 경력이 있어야 한다.
■ UDI대상 확대
의료기기 표준코드(UDI) 대상도 확대된다. MDD하에서는 치료나 진단 목적에 사용되는 기기들만이 포함됐지만 MDR에서는 컬러렌즈, 얼굴·피부·점막에 사용하는 필러, 지방 흡입·분해·성형기구, 피부 표면의 문신을 제거하는 레이저 제품 등 미용성형기구들도 UDI적용 대상이다.
한국에서는 신고로 판매가 가능한 1등급 의료기기(Class 1) 제품 일부도 인증 대상이다.
■ 기술문서·품질문서 추가사항
기술문서 작성방법 역시 강화됐는데, ▲명확하게 작성돼야 하며, ▲의료기기 구성을 이해할 수 있어야 하고, ▲문헌이나 논문 등이 검색 가능해야 한다.
작성 언어 역시 유럽에서 인정하는 공통언어여야 한다.
기술문서 외에 품질문서 관리 기준도 강화된다. 등급별로 분류해 보면 2등급 의료기기 및 일부 3등급 의료기기는 2년 혹은 1년에 한번씩 사후관리 내용 등을 업데이트 해야 하고 이는 반드시 기술문서에 반영돼야 한다.
3등급 혹은 임플란트 관련 기기는 매년 업데이트가 필요하다.
진흥원과 MDR인증 준비 중인 에코트론, 중점 사항은
이날 한국보건산업진흥원 지원으로 MDR 인증을 준비하고있는 에코트론 이상봉 부장은 MDR인증을 위한 서류 작성에 5개월 여가 걸렸다고 밝혔다.
에코트론은 진단용 X선 촬영장치를 수출하는 업체로 한국의료기기공업협동조합과 함께 보건산업진흥원 지원 프로그램에 참여했다.
이 부장은 "기술문서 작성 당시 MDD에서 요구하지 않았던 항목들인 제조사에 부품을 공급하는 공급업체 정보, PMS등 MDD기반 자료에서 MDR이 요구하는 자료룰 추가하는 형태로 작업을 진행했다"고 설명했다.
또한 그는 가장 큰 변화는 임상평가라고 말했다. 그는 "동등성평가, 임상문헌 평가 등이 MDD보다 강화됐다며 많은 근거를 자세하게 기제해서 안전하다는 것을 보여줘야 했다"고 말했다.
특히 에코트론은 임상평가를 진행하며 동등성을 비교하기위해 많은 유사기기들과의 동등성을 입증할 문헌과 문헌의 검색 경로, 문헌 중 발췌 부분 등을 보고서에 포함했다는 점도 덧붙였다.
"MDR 인증 준비업체 MDCG부터 다운 받아라"
나하나 팀장은 MDR 인증 작업에 착수하기 전 EU에서 공개하고있는 MDCG(Medical Device Coordination Group)부터 확보한 후 MDR 인증 기관을 찾아야 한다고 조언했다.
나 팀장은 "현재 유럽에는 55개 MDD인증기관과 21개 IVDD인증기관이 있고, 이들 중 MDR·IVDR 인증기관은 각각 15개, 4개"라며 "MDCG로 필요서류 개선점을 확인한 후 EU 인증기관 검색 포털인 Nando를 통해 MDR 및 IVDR 인증기관을 확보해야 한다"고 설명했다.
한편 현재 MDR인증 가능 기관은 ▲BSI Assurance UK Ltd(영국) ▲DEKRA Certification(독일) ▲IMQ ISTITUTO ITALIANO DEL MARCHIO DI QUALITA S.P.A(이탈리아) ▲TÜV Rheinland LGA Products GmbH(독일) ▲TUV SUD Product Service Gmbh(독일)과 TUV 라인란드(영국)을 포함해 총 6개로 확인되고 있다.

