정부, 제약 관련 규제개선 요청 51건 검토
긍정검토가 32건, 부정검토 19건으로 나뉘어
바이오헬스 산업에서 규제개선 필요성이 제기된 과제 중 5건이 수용곤란 또는 중장기검토가 필요한 것으로 분류됐다. 허가 전 심사 또는 수가를 받기 위해 생산한 의약품을 판매할 수 있게 허용해달라는 내용도 포함됐다.
25일 정부에 따르면 바이오헬스혁신위원회는 4차에서 6차까지 총 105건의 과제를 접수했다.
이를 산업별(제약, 의료기기, 기타·화장품), 검토부처별(복지부, 식약처 등), 과제유형별(법령정비, 행정간소화 등)로 분석하면 산업에서 △제약 51건, △의료기기 47건, △기타·화장품(7건이 있었다. 제약에서는 긍정 검토가 32건, 부정 검토가 19건, 의료기기에서 긍정 34건, 부정 13건, 기타·화장품은 긍정 3건, 부정 4건으로 집계됐다.
특히 혁신위는 제6차 회의에서, 지난 5차혁신위 이후 검토 완료과제 16건과 신규 발굴과제에서 중복 등 제외한 16건 과제의 검토결과 등 총 32건 보고했다.
규제개선이 필요한 것으로 접수된 32건 과제는 1차 부처 검토를 거친 후 추진단장 주재 관계부처 회의가 진행됐다. 이후 부처에서 재검토한 후 전문가 자문단회의, 부처 추가의견 및 보고 단계를 거쳤다.
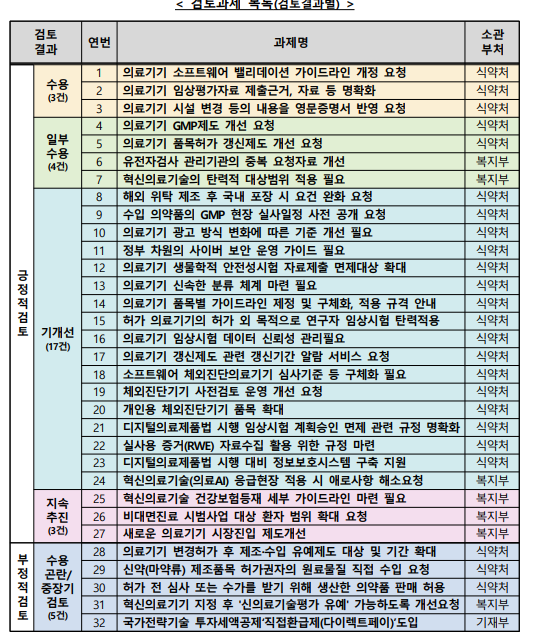
수용곤란 또는 중장기 검토 등 부정적으로 분류된 과제는 5건이다. △의료기기 변경허가 후 제조 및 수입 유예제도 대상 및 기간 확대, △신약(마약류) 제조품목 허가권자의 원료물질 직접 수입 요청 △허가 전 심사 또는 수가를 받기 위해 생산한 의약품 판매 허용 등 식약처 소관 3건이 부정적으로 검토됐다.
또한 혁신의료기기 지정 후 '신의료기술평가 유예' 가능하도록 개선을 요청했지만 복지부는 부정적으로 검토했고, 기재부는 국가전략기술 투자세액공제 '직접환급제(다이렉트페이)' 도입에 대해 곤란하다는 입장을 내놨다.
반면 27건은 긍정적으로 검토됐다. 의료기기 소프트웨어 밸리데이션 가이드라인 개정, 의료기기 임상평가자료 제출 근거 명확화, 의료기기 시설 변경 등의 내용을 영문증명서 반영 요청 등은 식약처가 수용하기로 했다.
의료기기 GMP제도 개선(식약처)과 의료기기 품목허가 갱신제도 개선(식약처), 유전자검사 관리기관의 중복 요청자료 개선(복지부), 혁신의료기술의 탄력적 대상범위 적용(복지부) 등은 일부 수용키로 했다. 특히 이들 과제는 주요 과제로 선정됐다.
이와 함께 혁신의료기술 건강보험등재 세부 가이드라인 마련과 비대면진료 시범사업 대상 환자 범위 확대, 새로운 의료기기 시장진입 제도 개선은 지속 추진하는 것으로 검토됐다.

