소비와 합작 법인 '한독법인', 국내 도입 신약 2번째 성과
클라우딘 18.2 타깃 위암 치료제 'AZD0901' 3상 승인
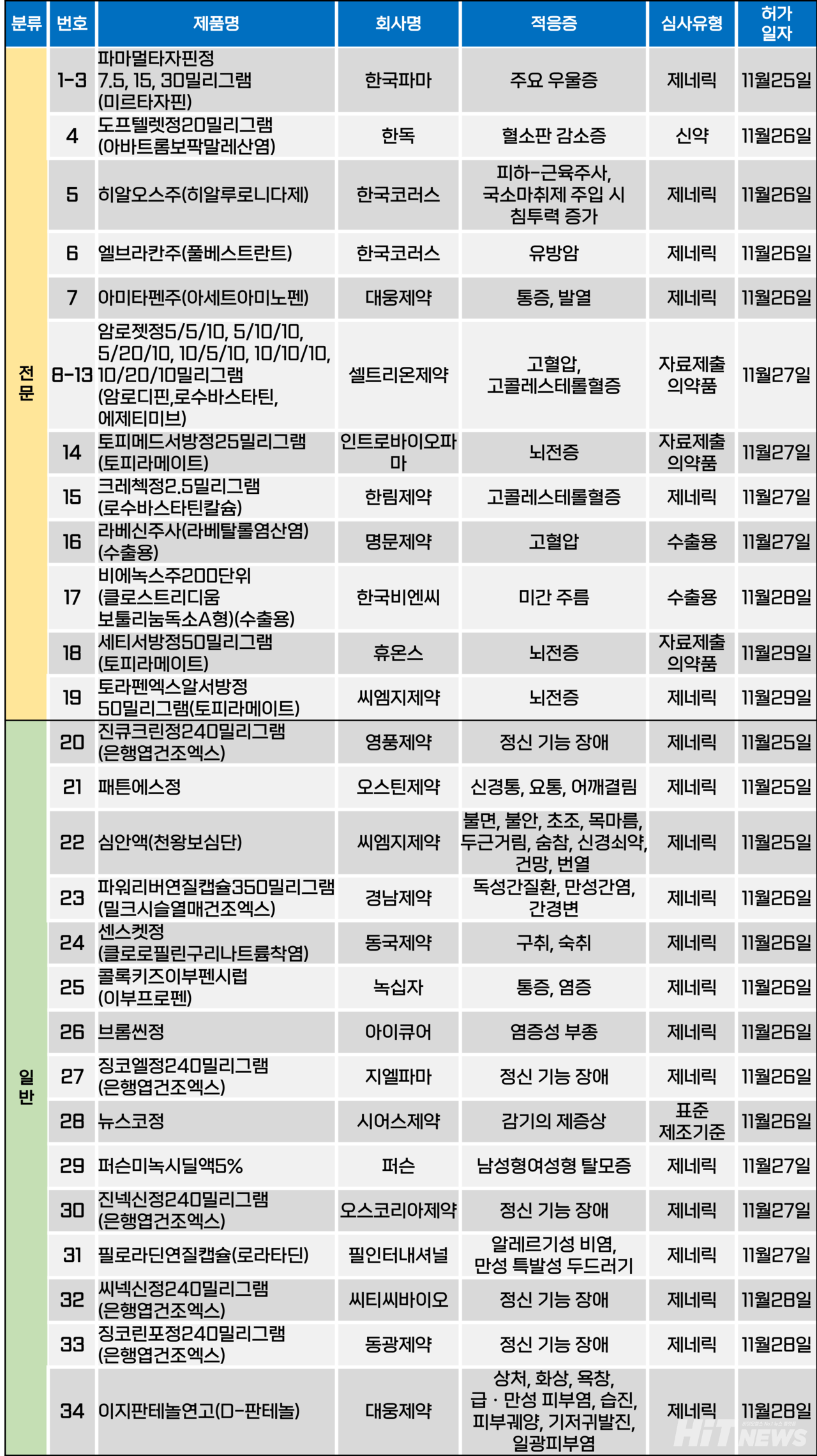
지난주(11월 25~29일) 총 34개 품목이 식품의약품안전처에서 품목허가를 받았다. 전문의약품은 19개, 일반의약품은 15개 품목이다. 이들은 주요 우울증, 혈소판 감소증, 고혈압, 고콜레스테롤혈증, 뇌전증 등 다양한 적응증으로 허가됐다.
한독이 글로벌 바이오제약기업 소비(Swedish Orphan Biovitrum, Sobi)와 합작 설립한 '한독소비(Sobi-Handok)'의 2번째 신약 도입 성과가 나왔다.
한독은 소비가 개발한 혈소판 감소증 치료제 '도프텔렛(성분 아바트롬보팍말레산염)'을 지난달 26일 식약처로부터 허가받았다.
도프틸렛은 면역성 혈소판 감소증(ITP) 성인 환자의 치료를 위한 경구용 트롬보포이에틴 수용체 작용제(TPO-RA)다. 이번 허가로 ①시술 예정인 성인 만성 간질환 환자에서 혈소판감소증 치료 ②이전 치료(코르티코스테로이드 또는 면역글로불린 또는 비장 절제술)에 불충분한 치료 반응을 보인 성인 만성 면역 혈소판감소증 환자에서 혈소판감소증 치료 등에 사용할 수 있게 됐다.
한독은 지난 4월 소비와의 합작법인 설립 출범식에서 총 4개의 신약을 도입할 계획이라고 밝힌 바 있다. 이 중 현재까지 허가된 희귀질환 치료제는 발작성 야간혈색소뇨증(PNH) 치료제 '엠파벨리(성분 페그세타코플란)'와 도프텔렛을 포함해 2개다. 글로벌 시장 조사기관에 따르면, 작년 기준 엠파벨리와 도프텔렛의 글로벌 매출 규모는 각 1909억원, 3896억원이다.
두 회사의 협약에 따라 향후 △혈구탐식성림프조직구식증 치료제 '가미판트' △혈소판감소증 동반 골수섬유증 치료제 '본조' 등이 추가로 국내 허가될 것으로 전망된다.
한편, 한독소비는 희귀질환 비즈니스를 위해 한독과 소비가 49대 51의 지분율로 설립한 합작법인이다. 대표는 게르하르드 파셋(Gerhard Passet) 소비 아시아태평양 GM/부사장이 맡았다.

임상시험계획은 총 20건이 승인됐다. 세부적으로 △1상 5건 △1/2상 2건 △1/2a상 1건 △2상 5건 △2b상 1건 △3상 3건 △생물학적 동등성 2건 △연구자 임상 1건 등이다. 이 임상시험들은 성장부전, 고혈압, 특발성 폐섬유증, 혈관부종 발작, 제2형당뇨병 등 질환과 HER2 액손20 삽입 또는 MET 변이 또는 MTAP 결손 비소세포폐암, 클라우딘 18.2 발현 위선암/위식도접합부 선암 등 암종을 대상으로 승인됐다.
아스트라제네카가 개발 중인 '클라우딘 18.2' 타깃 항체약물접합체(ADC) 신약 후보물질인 'AZD0901(개발코드명)'의 3상 임상시험계획이 지난달 29일 승인됐다.
이번 3상 임상시험(연구명 CLARITY-Gastric 01)은 클라우딘 18.2를 발현하는 진행성/전이성 위선암 또는 위식도 접합부 선암 환자의 2차 또는 그 이후 차수 치료에서 시험자가 선택한 요법과 AZD0901의 단독요법을 비교하는 다기관, 라벨 공개, 의뢰자 눈가림, 무작위배정 시험이다. △서울대병원 △분당서울대병원 △세브란스병원 △삼성서울병원 △서울아산병원 등 의료기관에서 진행된다.
아스트라제네카는 2022년부터 예후가 좋지 않은 위암ㆍ췌장암 등 바이오마커가 한정적인 암종에 효과적으로 작용할 수 있는 클라우딘 18.2 타깃 물질들을 중국 바이오기업들로부터 도입해 왔다. AZD0901도 그 일환이다.
회사는 2022년 4월 중국 바이오기업인 '하버바이오메드'로부터 클라우딘18.2와 CD3 등을 동시 타깃하는 이중특이항체 'HBM7022'를 도입했다. 또 2023년 2월에는 같은 타깃을 표적하는 이중특이항체 'CMG902'를 'KYM바이오사이언스'로부터 도입한 바 있다.
이번 임상은 지난 2월 28일 진행된 AZD0901 대상 2상 임상시험과는 차이점이 존재한다. 당시 연구진은 임상을 2개의 하위시험(①국소 진행성ㆍ전이성 위암 및 위식도 접합부암 환자 ②췌장암의 일종인 췌장 도관선암 환자)으로 나눠 실시했으며, 단독 및 병용요법(△5FU △류코보린 △이리노테칸/나노-리포솜 이리노테칸 △젬시타빈)을 모두 평가했다.

