벤리스타 피하투여 장기 안전성·유효성 확인 위한 공개 임상
작년 7월 21일 위약 대조 2/3상 임상 이어 2번째
美 2017년 7월 21일부터 루푸스 환자 피하제형 사용중…국내는 미허가
루푸스 치료제 벤리스타(성분 벨리무맙)의 '전신 경화증 관련 간질성 폐 질환(SSc-ILD)' 대상 피하투여 장기 안전성 확인 3상 임상시험계획이 승인되면서, 향후 국내 환자들도 피하제형 제품을 사용할 수 있을 지 주목된다.
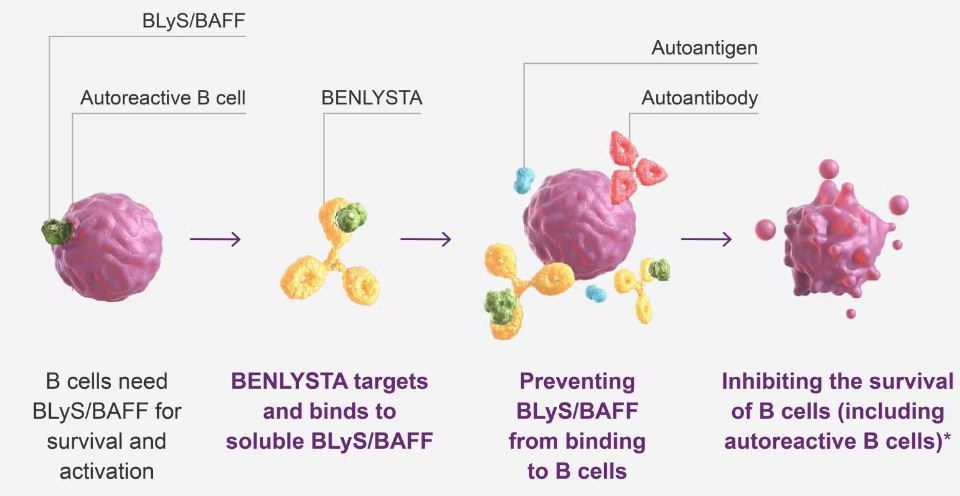
GSK가 개발한 벤리스타는 전신홍반루푸스 및 루푸스신장염의 주요 원인으로 지목되는 B세포 활성화 인자(B-cell activating factor·BAFF)와 B림프구 자극 단백질(B-lymphocyte stimulator protein·BLyS)을 타깃해 자가항체 생성을 억제하는 자가면역질환 치료제다.
현재 국내에서 △ 표준요법으로 치료 중인 자가 항체 양성인 활동성 전신홍반루푸스 성인 및 소아(만 5세 이상) 환자의 치료 △ 표준요법으로 치료 중인 활동성 루푸스 신장염 성인 환자의 치료 등 적응증으로 허가돼 있다.
GSK는 19일 식품의약품안전처에서 SSc-ILD가 있는 성인에게 피하 투여한 벨리무맙의 장기 안전성과 유효성을 연구하기 위한 공개 3상 임상시험계획을 승인받았다.
이번 임상은 국내 11명의 환자(글로벌 225명)를 목표로 오는 2029년 12월까지 △순천향대 서울병원 △한양대병원 △서울성모병원 △서울아산병원 △아주대병원 등 의료기관에서 진행된다.
참여 환자들은 일주일에 한 번 피하에 벤리스타를 투여받게 되며, 연구진은 '이상반응이라고 예상 및 의도하지 않은 의학적 문제를 비롯해 중대한 이상반응 및 특별 관심 대상 이상반응의 발생'을 일차 유효성평가변수로 평가하게 된다. 아울러 주요 이차 유효성평가변수로 시험 시작부터 여러 특정 시점까지의 강제 폐활량(Forced Vital Capacity·FVC)의 절대 변화값을 측정하게 된다.
이번 임상승인을 주목하는 이유는 피하 투여 제형의 벤리스타를 국내에서 사용할 수 있을지 기대감 때문이다.
회사는 이미 작년 7월 21일부터 벤리스타와 위약 피하 투여간 유효성을 평가하기 위한 무작위배정, 이중눈가림, 대조 2/3상 임상을 진행해왔다.
더불어 벤리스타는 이미 해외에서 피하 제형으로 개발돼 사용되고 있다. 회사는 2017년 7월 21일(현지시간) 미국 FDA로부터 전신홍반루푸스 환자를 대상으로 한 피하주사제형의 품목허가를 획득한 바 있다. 전신홍반루푸스를 대상으로 환자 자가 투여가 가능하도록 허가된 첫 품목이었다. 2022년 그 범위를 소아(만 5세 이상)로 확대했으며, 지난 2월에는 SSc-ILD 치료를 위한 희귀의약품으로 지정되기도 했다.
자가 피하 투여 제형의 경우, 환자가 매 투여 시 병원을 방문하지 않아도 되는 점, 1시간가량의 정맥 투여 시간을 현저히 낮출 수 있다는 점 등 최근 질환 분야에 국한되지 않고 개발되고 있는 추세다.
그럼에도 국내에서는 2013년 정맥 투여 제형의 벤리스타가 최초 허가된 후, 피하 투여 제형으로의 허가는 진행되지 않고 있다. 회사 측도 이번 임상이 향후 벤리스타의 피하 투여 제형 개발로 이어질 지는 구체적으로 밝힐 수 없다는 입장이다.
회사 관계자는 "GSK는 SSc-ILD 환자의 치료 접근성을 높이기 위한 다양한 임상을 진행중에 있다"며 "다만, 현재 공개된 임상 외의 향후 계획에 대해선 아직 말씀드리기 어렵다"고 밝혔다.
한편, 국내에 허가된 SSc-ILD 치료제로는 베링거인겔하임이 개발한 경구용 치료제 '오페브(성분 닌테다닙)'가 있다. SSc-ILD 외 특발성폐섬유증, 만성 섬유성 간질성폐질환 치료제로 사용되는 오페브는 2016년 허가 이후 지금까지 급여 문턱을 넘지 못하고 있다.

