슬린다, 에스트로겐 부작용 우려 적어 흡연자도 복용 가능
지씨셀, NK 및 T세포 림프종 치료제 후보물질 'GCC2005' 1상 승인
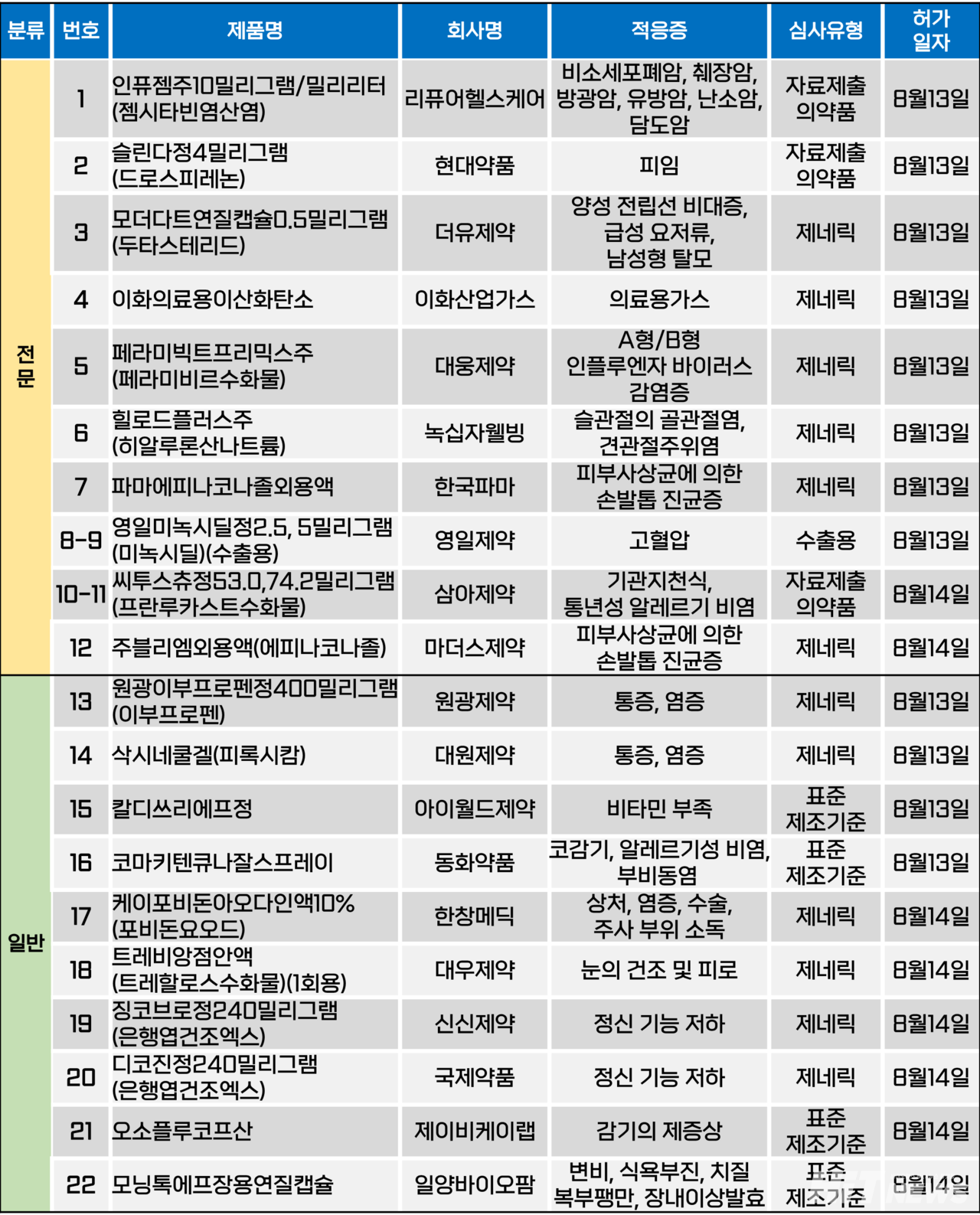
지난주(8월 12~16일) 총 22개 품목이 식품의약품안전처에서 품목허가를 받았다. 전문의약품은 12개, 일반의약품은 10개 품목이다. 이들은 양성 전립선 비대증, A형 또는 B형 인플루엔자 바이러스 감염증, 손발톱 진균증, 고혈압, 기관지천식 등 다양한 적응증으로 허가됐다.
현대약품은 지난 13일 식약처로부터 사전 피임약 '슬린다정4밀리그램(성분 드로스피레논)'의 품목허가를 획득했다.
앞서 현대약품은 2022년 일본 아스카제약(ASKA Pharmaceutical)으로부터 슬린다의 국내 독점 라이선스 계약을 체결했으며 이에 따라 국내 상용화에 대한 권리를 갖게 됐다.
슬린다는 스페인 마드리드에 본사를 두고 있는 다국적 제약사인 인수드 파마(Insude Pharma)의 여성 의료 전문 브랜드 사업부인 엑셀티스(Exeltis)가 개발한 제품이다.
슬린다정은 프로게스토겐 계열 성분인 드로스피레논 제제로, 에스트로겐 성분을 포함하지 않는다. 회사 측은 이에 에스트로겐 관련 부작용 우려가 적으며, 기존 피임약 사용에 어려움이 있었던 35세 이상의 흡연자도 사용할 수 있다는 점을 특징으로 꼽았다.
회사는 이번 허가로 자사 응급 피임약 '엘라원정', '노레보원정', 2세대 사전 피임약 '라니아정', 3세대 사전 피임약 '보니타정', 4세대 사전 피임약 '야로즈정' 등에 더해 제품 라인업을 확장하게 됐다.
회사 관계자는 "세계보건기구(WHO)는 지침을 통해 슬린다와 같은 프로게스틴 단일제 피임약(Progestin only pill·POP)은 흡연, 비만, 고혈압, 판막성 심장질환, 동맥성 심장질환에 대한 다중 위험 요소(고령, 흡연, 당뇨, 고혈압)를 가진 여성과 심부정맥혈전증, 폐색전증 경험이 있는 여성에게도 사용할 수 있다고 권고하고 있다"며 "슬린다가 부작용으로 인해 피임제 사용이 어려웠던 여성들에게 새로운 처방 옵션을 제공할 것으로 기대된다"고 말했다.
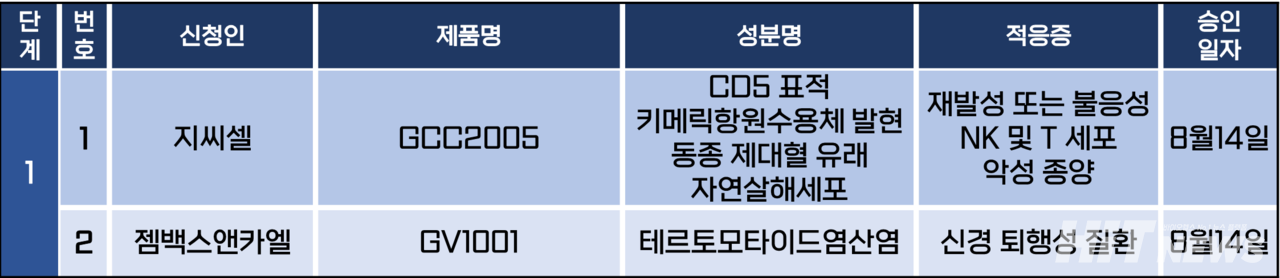
임상시험계획은 1상에 대한 2건 만이 승인됐다. 세부적으로 이 임상시험들은 재발성 또는 불응성 NK세포 또는 T세포 악성 종양, 신경 퇴행성 질환 등 질환을 대상으로 승인됐다.
지씨셀은 지난 14일 NK세포 및 T세포 림프종 치료제로 개발중인 후보물질 'GCC2005(CD5 CAR-NK)'의 1상 임상시험계획(IND)을 승인받았다.
GCC2005는 제대혈 유래 NK세포로 제작된 동종유래 세포치료제로, T세포 림프종에서 높게 발현되는 CD5 단백질을 표적으로 한다.
이번 1상 임상은 재발성 또는 불응성 NK 및 T 세포 악성 종양 환자 치료에서 림프구 제거 화학요법과 병용하는 GCC2005의 안전성, 내약성 및 예비 유효성을 평가하기 위한 다기관 연구다.
임상 참여 목표 환자는 48명으로, 2027년 12월까지 서울대병원에서 실시될 예정이다. 연구의 일차유효성평가변수는 △사이토카인 방출 증후군(CRS)을 포함한 미국 국립 암 연구소 공통용어기준(NCI CTCAE) v.5.0 이상사례(AE) △3등급 이상의 AE의 빈도 △중증도 및 지속성 △미국 이식 및 세포 치료 학회(ASTCT) 기준 신경독성 △MAGIC(Mount Sinai Acute GvHD International Consortium)에 기반한 급성 GvHD △미국 국립보건원 2014 기준 기반 만성 이식편대숙주병(GvHD) △치료유발 이상사례(TEAE)의 발생률 등이다.
한편, 회사 측은 GCC2005가 CAR와 IL-15를 공동 발현해 기존 NK세포의 짧은 지속성을 개선했고, 효력을 증강한 CAR NK 세포치료제라고 소개했다. 더불어 대량 생산 및 동결보존(Cryopreserve) 플랫폼을 통해 자가유래 CAR-T 대비 가격 경쟁력이 높고, 즉시 투여가 가능한 기성품(Off-the-shelf) 치료제로서의 장점을 가지고 있다고 밝혔다.

