평가원 신속심사과, 협회에 20일까지 RTOR 경험 전문가 요청
"협의체 월 1회 운영해 심사 정보집 오는 11월까지 마련 예정"

식품의약품안전처 식품의약품안전평가원(원장 서경원)이 '실시간 항암제 심사(Real-Time Oncology Review, RTOR) 해외 정보집' 마련을 위한 전문가 모집에 나섰다.
최근 평가원 신속심사과는 한국제약바이오협회 등을 통해 항암제 실시간 심사 해외 정보집 마련을 위한 협의체 위원 추천을 요청했다.
신속심사과는 공문을 통해 "실시간 항암제 심사 해외 정보집 마련을 위한 협의체를 구성·운영하니, FDA의 항암제 실시간 심사 등 관련 경험이 있는 회원사의 전문가를 오는 20일까지 추천해 달라"고 전했다.

RTOR은 미국 FDA OCE(Oncology Center of Excellence, 항암 의료제품 중심조직)가 운영하고 있는 심사 프로그램으로, 2018년 2월부터 파일럿 프로그램으로 시행하고 있다. OCE는 △항암제 연구개발 향상 △심사제도 발전 △항암제 근거의 개선 △항암제 접근성 제고 △항암제에 대한 인식 확대 및 교육 등을 목적으로 다양한 프로그램을 가동하고 있는데, RTOR 또한 이 프로그램에 속한다.
식약처가 발간한 '미국 의약품 규제 동향 정보집 7호'에 따르면, RTOR은 항암제 허가신청을 위한 eCTD(electronic common technical document, 전자국제공통기술문서) 자료 전체가 준비되기 전에 허가신청자가 개별 섹션의 자료를 제출해 FDA가 일찍 자료를 검토할 수 있게 하는 프로그램이다.
FDA 심사관이 조기에 자료를 검토하게 함으로써, 심사가 효율적으로 진행되고 결과적으로 제품이 시장에 일찍 진입할 수 있게 한다는 것이다.
비슷한 개념의 신속심사 프로그램인 동반심사(Rolling review)가 eCTD 전체 모듈을 제출하도록 요구하는 것에 비해, 핵심 섹션 자료만을 조기에 제출할 수 있다는 것은 큰 이점으로 작용한다.
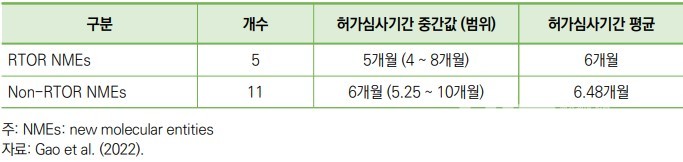
OCE는 이 프로그램을 초기 기존 약의 적응증 추가 신청에만 적용해오다가, 2018년 12월부터 신물질 신약과 동반진단(companion diagnostics, CDx) 등도 대상에 포함했다.
다이이찌산쿄와 아스트라제네카가 개발한 항체약물접합체(ADC) 엔허투(성분 트리스투주맙 데룩스테칸) 또한 RTOR 프로그램을 통해 'HER2 저발현 유방암'을 대상으로 적응증을 확대한 바 있다.
한편 신속심사과 관계자는 이번 RTOR 전문가 모집과 관련해 히트뉴스에 "국내 신속심사 대상 항암제의 허가심사 효율성 향상을 위해 RTOR 해외 현황 및 체계 파악을 위해 정보집을 마련하고자 한다"며 "협의체 마련 또한 그 일환"이라고 밝혔다.
이어 "협의체가 구성되면 회의는 대략 월 1회 진행할 계획이며, 심사 정보집 마련은 오는 11월로 예상한다"고 덧붙였다.

