이재영 툴젠 이사, 2022 첨단바이오의약품 규제과학 컨퍼런스 발표
In Vivo 유전자편집 임상개발 사례로 인텔리아, 에디타스 소개
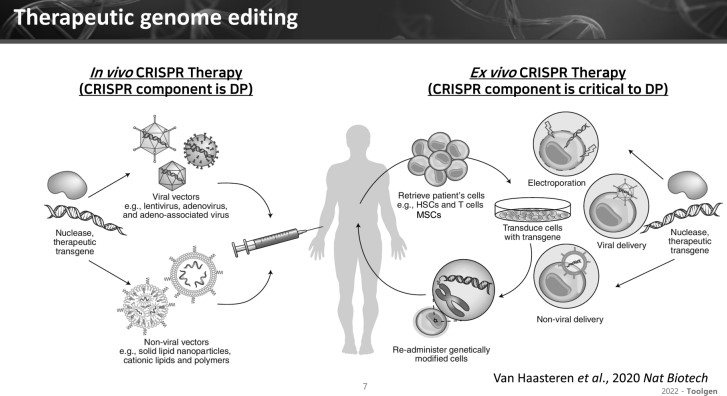
AAV(아데노 관련 바이러스), LNP(지질나노입자) 방식의 유전자 편집 치료제의 임상이 활발하다.

이재영 툴젠 R&D 개발 이사는 14일 첨단바이오의약품 규제과학 컨퍼런스에서 "2012년 발견된 CRISPR Cas9(크리스퍼 캐스9, 유전자 가위)을 기반으로 한 유전자편집 치료제는 단백질 공학 없이 누구나 손 쉽게 유전자를 편집 가능하게 하며 '유전자편집 계의 민주화'를 가져왔다"고 설명했다.
유전자 편집과 유전자 치료는 기본 개념이 다르다.
유전자 치료는 기존 돌연변이 유전자를 그대로 두고, 치료 유전자를 체내에서 과발현 시켜 이로부터 생성되는 정상 단백질과 돌연변이가 함께 생성되는 형태며, 유전자 편집은 돌연변이 유전자 자체를 편집, 교정해 정상화된 단백질을 형성하게 한다.
이 이사에 따르면, 유전자 편집 치료제는 체내 AAV, LNP에 CRISPR Cas9 컴포넌트를 삽입해 주입하는 인비보(In vivo) 방식과 체외로 세포를 꺼내 유전자 편집을 거친 뒤 주입하는 엑스비보(Ex vivo) 방식이 있다.
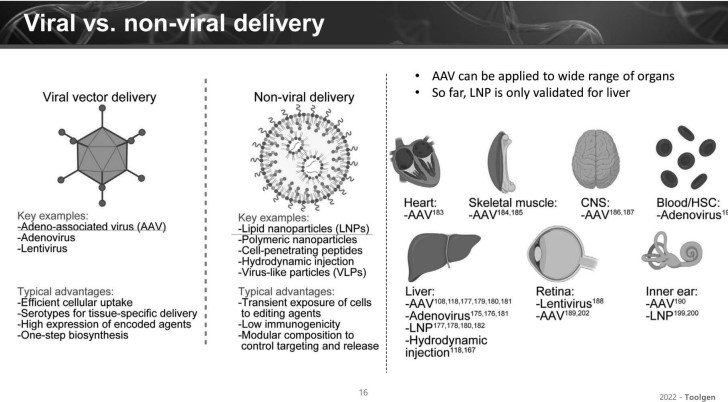
인비보 유전자 편집 치료제에서 사용되는 AAV, LNP는 각가의 장단점이 존재한다.
이 이사는 "AAV는 여러 종류의 캡티드가 발견됐고, 또 계속해서 가공되고 있어 다양한 장기로 전달될 수 있는 장점이 있는 반면, LNP는 현재까지 임상적으로 효율적인 전달이 확인된 장기는 백신을 제외하고는 간에 국한돼 있다"고 설명했다. 다만, LNP는 유전자 편집 측면에서 체류만 할 뿐, 편집이 끝난 후 자연스럽게 제거될 수 있다는 장점을 가진다.
그는 현재 시중에 활발히 임상을 진행하고 있는 인비보 및 엑스비보 유전자편집 치료제 사례를 소개했다.
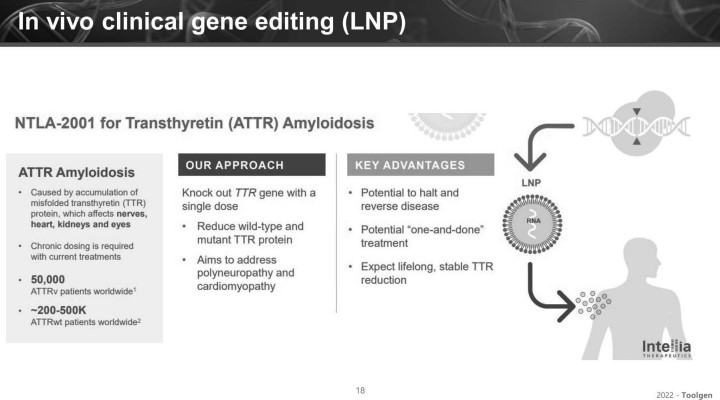
LNP CRISPR mRNA 치료제의 성공 사례는 인텔리아(Intellia)의 ATTR 아밀로이도시스(Amyloidosis) 프로그램이 소개됐다
ATTR은 TTR 유전자 변이로 인해 이 TTR 단백질의 오접힘(MIsfolding)이 일어나서 아밀로이드가 축적되는 질환이다. 이 질환은 다양한 장기 중 특히 신경 및 심장의 아밀로이드가 과하게 축적될 수 있다고 알려져 있으며, 말초신경병증과 심장병증과 같은 임상 증상이 심각하게 발발하는 질환으로 알려져 있다.
이 이사는 "인텔리아는 TTR 유전자를 타깃하는 가이드 mRNA와 Cas9 mRNA를 LNP에 봉합해 치료제를 개발하고 있다"며 "혈중의 TTR 대부분은 간에서 형성되기 때문에, 이를 타깃하는 LNP CRISPR를 혈관 투여해 간에서 TTR을 녹아웃시키는 전략을 통해 현재 임상 1/2상을 수행하고 있다"고 밝혔다.
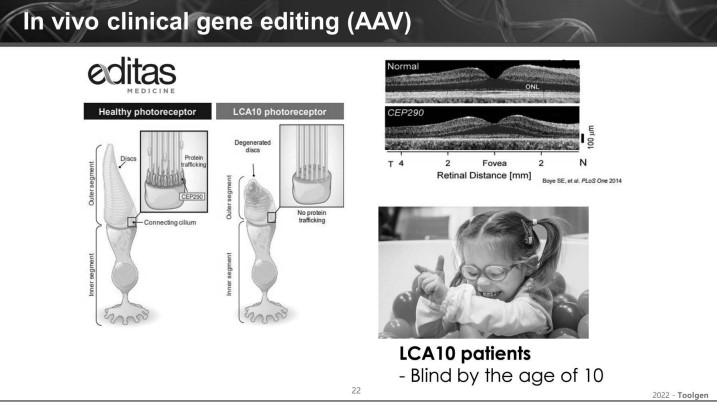
또한 AAV를 사용한 사례로는 미국 에디타스(Editas)의 유전질환 LCA 10 CRISPR 치료제가 소개됐다.
LCA 10은 CEP290 이라고 하는 안구의 광수용체 관련 유전자의 결함이 생겨 문제가 생기는 질환으로 환자들의 시신경막이 눈에 띄게 얇아져 10살 전 눈이 멀게 되는 치명적인 질환이다.
그는 "LCA10 환자들의 대부분은 CEP290의 IVS26V 부위에 돌연변이가 생겨 그 안에 치명적인 엑손(유전자 번역부위)이 생기게 된다"며 "이를 고치기 위해 에디타스는 IVS26V 돌연변이 부위 양쪽을 잘라냄으로써 정상적인 CEP290의 형성을 도모하는 유전자 편집을 이용해 임상개발을 수행하고 있다"고 밝혔다. 이어 "전달체로써 AAV5 벡터를 사용하고 있으며, 돌연변이가 일어난 부위 양쪽에 다른 가이드 mRNA 두가지와 광수용체 부위에 국한돼 Cas9을 전달하는 형태로 유전자 편집 컴포넌트를 만들어 연구를 진행하고 있다"고 덧붙였다.
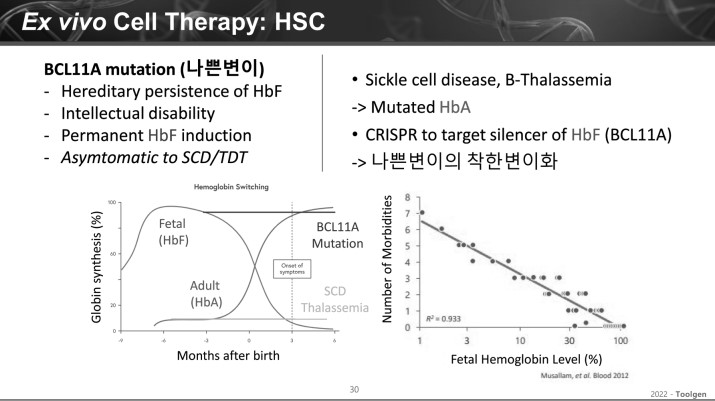
엑스비보 유전자 편집 치료제는 조혈모줄기세포 기반 치료제가 소개됐다.
이 이사에 따르면, 엑스비보 유전자 편집 기반 조혈모줄기세포 치료제 제작을 위해서는 먼저 환자의 몸에서 조혈모줄기세포를 꺼낸 뒤, CRISPR Cas9 컴포넌트를 이에 주입해 유전자 편집을 수행한 뒤 환자의 몸으로 다시 주입하는 방법으로 진행한다.
가장 많이 연구되고 있는 질환은 겸상적혈구병 환자 글로빈유전자 중 원래 A 염기가 와야 하는 곳에 T염기가 오면, 적혈구가 낫모양으로 바뀌게 돼 빈혈 등 다양한 증상들을 유발할 수 있다.
태아 시절 헤모글로빈 단백질은 HbF 형태를 띄다가 점차 성인 헤모글로빈에서 HbA형태로 바뀌게 된다. 이때 겸상적혈구병 환자는 HbA 형태가 아예 없어지게 되며 발병된다.
이 이사는 "이 질환 원인을 타깃하기 위해 과학자들은 BCL11A 부위에 돌연변이가 있는 사람들을 주목하기 시작했다"며 "이 유전자에 변이가 있는 사람들은 성인이 되서도 헤모글로빈 HbF 형태가 없어지지 않고 유지됨을 발견했고, 과학자들은 이를 활용하고자 했다"고 설명했다.
특히, HbF가 계속 유지됨에 따라 겸상적혈구병이 발생하지 않음을 발견했다. 그는 "과학자들은 이를 활용해 CRISPR 치료제에서 적혈구 BCL11A의 인헨서(유전자 전사제어 부위)를 타깃해 적혈구에서의 헤로글로빈 수준을 올리기 위해 전기 천공법을 통해 CRISPR Cas9 형태로 환자에 전달했다"고 말했다. 이어 "임상 결과 유전자편집 조혈모줄기세포 치료제를 이식받은 환자들은 정상 헤모글로빈 수준이 성인이 되서도 계속해서 증가해 있는 것을 발견할 수 있었다"고 덧붙였다.
그는 "이런 임상 사례들을 보면 유전자편집 치료제는 충분한 치료적 가치가 있다"며 "각국의 의약품 규제기관 등 정부 기관에서 유전자 편집 치료제의 리스크와 이점을 잘 파악하고, 이에 맞는 규제와 제도를 잘 마련해 준다면 치료제가 없거나 더 나은 치료제가 필요한 환자들에게 큰 도움이 될 수 있을 것"이라고 밝혔다.

