5일 ‘경증·중등증 대상 코로나19 항바이러스 치료제 임상시험 가이드라인’ 발간
기존 평가지표 중증예방 효과 외 중증개선 효과 추가
"임상시험 대상자 빠른 모집 가능해 신속 치료제 개발 도움될 것"

식품의약품안전처가 코로나19 항바이러스 치료제의 신속한 개발을 지원하기 위해 새로운 임상 평가지표를 추가했다.
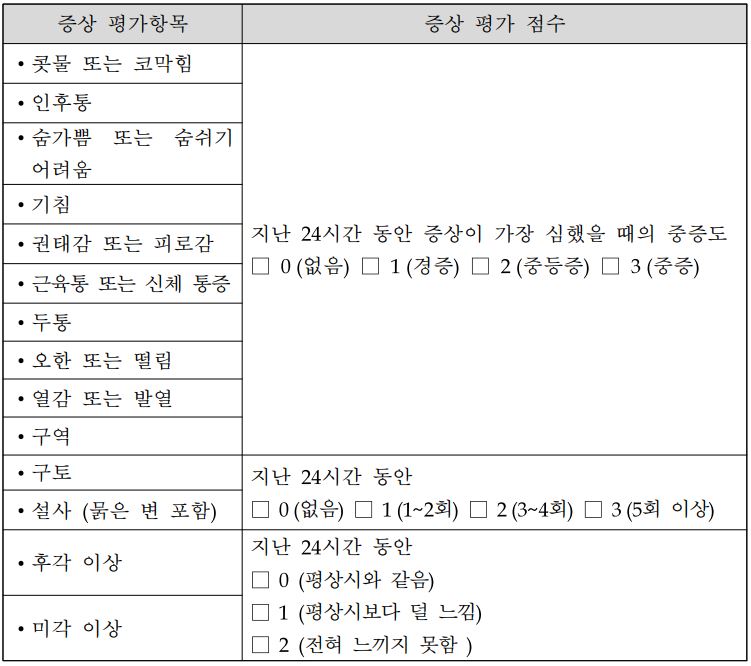
식약처가 지난 5일 발간·배포한 '경증․중등증 대상 코로나19 항바이러스 치료제 임상시험 가이드라인'에 따르면, 기존 임상 평가지표는 중증예방 효과에 한정됐으나 증상개선 효과가 새로운 평가지표로 추가됐다.
왕소영 식품의약품안전평가원 제품화전략지원단 임상심사팀장은 "백신 추가 접종 등으로 중증환자가 감소함에 따라 임상시험 수행에 어려움이 있어왔다"며 "이에 따라 코로나19 감염병 현황에 맞는 새로운 지표 설정이 불가피해 새로운 평가지표를 추가하게됐다"고 밝혔다.
이어 "새로운 평가지표 추가로 임상시험 대상자 빠른 모집 등 임상시험 진행이 용이해져 신속한 치료제 개발에 도움이 될 것으로 기대된다"고 설명했다.
이 가이드라인은 지난 8월 11일 '식의약 규제혁신 100대 과제' 중 코로나19 백신․치료제 개발을 지원하기 위한 신속 임상 지원 플랫폼 마련을 본격적으로 추진하기 위해 마련됐다.
주요 내용은 △경증, 중등증 코로나19 환자 대상 치료제 임상시험 시 새로운 임상 평가지표 추가 △시험대상자 선정 △임상적 치료효과 평가 방법 △유효성 평가 및 임상 설계·수행 시 고려사항 등이다.
왕 팀장은 "임상 평가지표 추가 외에도 임상시험계획서 마련 시 중간 분석 결과를 근거로 자체적으로 시험대상자 수 등을 적절히 변경할 수 있는 적응적 설계 도입이 가능하도록 안내해 예측 가능성과 투명성을 높였다"며 "사전에 임상시험계획 승인을 받은 경우 추가 승인 없이 임상시험을 수행할 수 있어 기간 단축에 도움이 될 것으로 기대된다"고 말했다.
한편, 이 가이드라인은 전염성 환자를 대상으로 한 임상시험임을 고려해 비대면 임상시험 시 주요 고려사항과 사례 또한 안내하고 있다.

