에소메졸디알서방캡슐 10mg 추가돼 총 3품목... 2021년 88억원
한올바이오파마, 중국·일본 이어 국내에서 '바토클리맙' 3상 승인

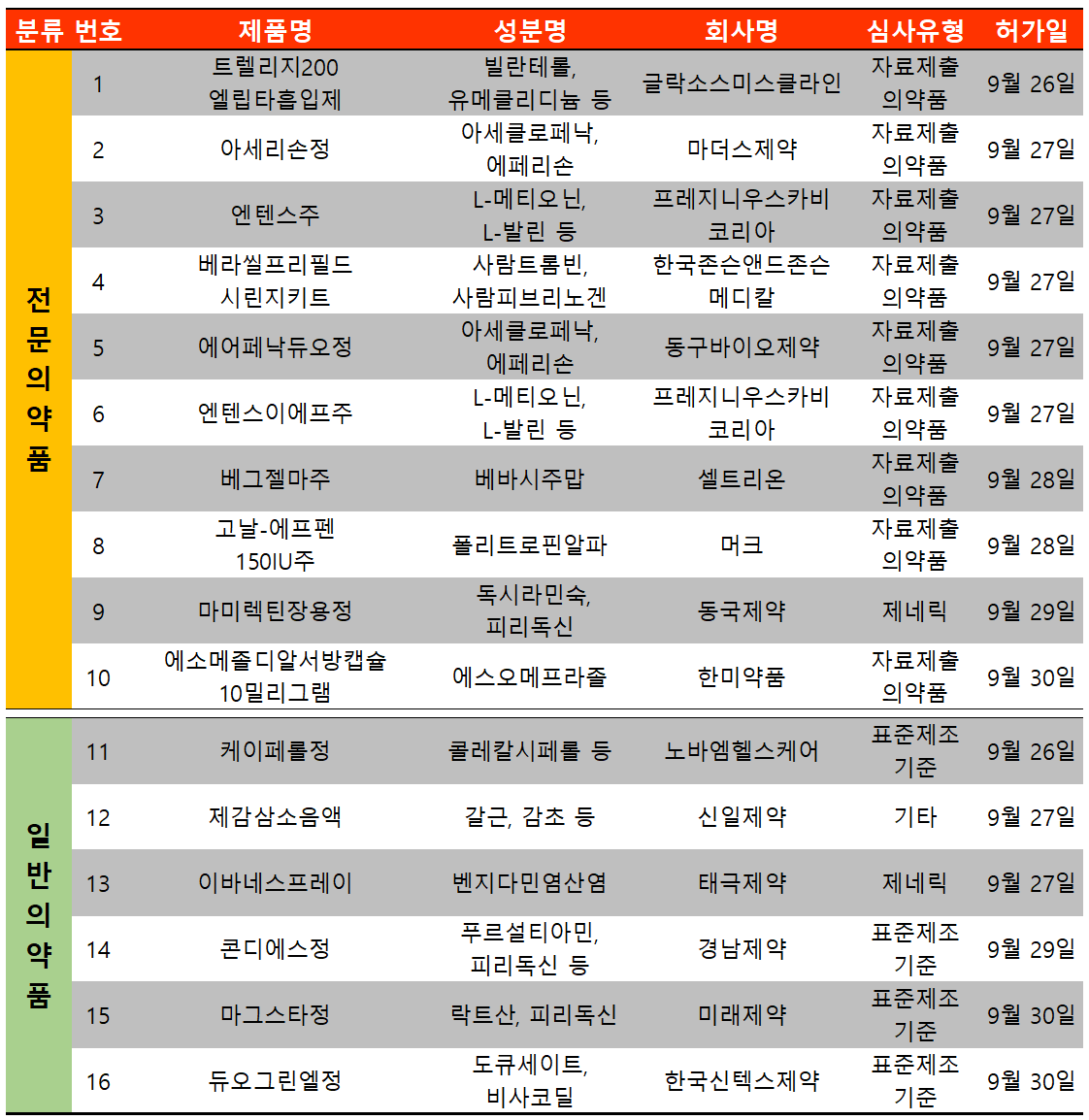
지난 주(9월 26일~10월 3일) 16개 품목이 식품의약품안전처에서 허가받았다. 전문의약품은 10건, 일반의약품은 6건이었다.
한미약품이 위염 치료제인 에소메졸디알서방캡슐(성분 에스오메프라졸)10mg을 허가받아 에소메졸 패밀리의 영역을 넓혔다.
에소메졸디알서방캡슐은 식사와 관계없이 복용 가능한 에스오메프라졸마그네슘삼수화물 성분의 서방형 위식도역류질환 치료제로, MUST polycap 특허 기술이 적용된 이중지연방출 제형을 통해 약효지속 시간을 개선한 전문의약품이다.
에소메졸디알서방캡슐은 국내 미란성 역류식도염 환자 대상 3상 임상시험에서 투여 8주차에 약 98%의 치료율을 나타냈다.
한미약품은 이번 저용량 품목뿐만 아니라 에소메졸디알서방캡슐 20mg, 40mg 품목을 보유하고 있으며 식도역류질환 치료에 쓰이는 대표적인 PPI(proton pump inhibitor) 성분인 에스오메프라졸에 제산제인 수산화마그네슘을 결합한 위식도역류질환 복합신약 '에소메졸플러스정' 품목 또한 보유 중이다.
이에 따라 에소메졸캡슐, 에소메졸디알서방캡슐, 에소메졸플러스정 등 총 3가지 품목을 합쳐 통칭 '에소메졸패밀리'로 부르며 패밀리의 시작인 에소메졸캡슐의 경우 2008년 첫 출시 이래 작년까지 유비스트 기준 누적 처방 매출 3000억원을 기록했다.
한편 에소메졸디알서방캡슐의 경우 유비스트 기준 2021년 원외처방액 약 88억원으로 집계됐다.
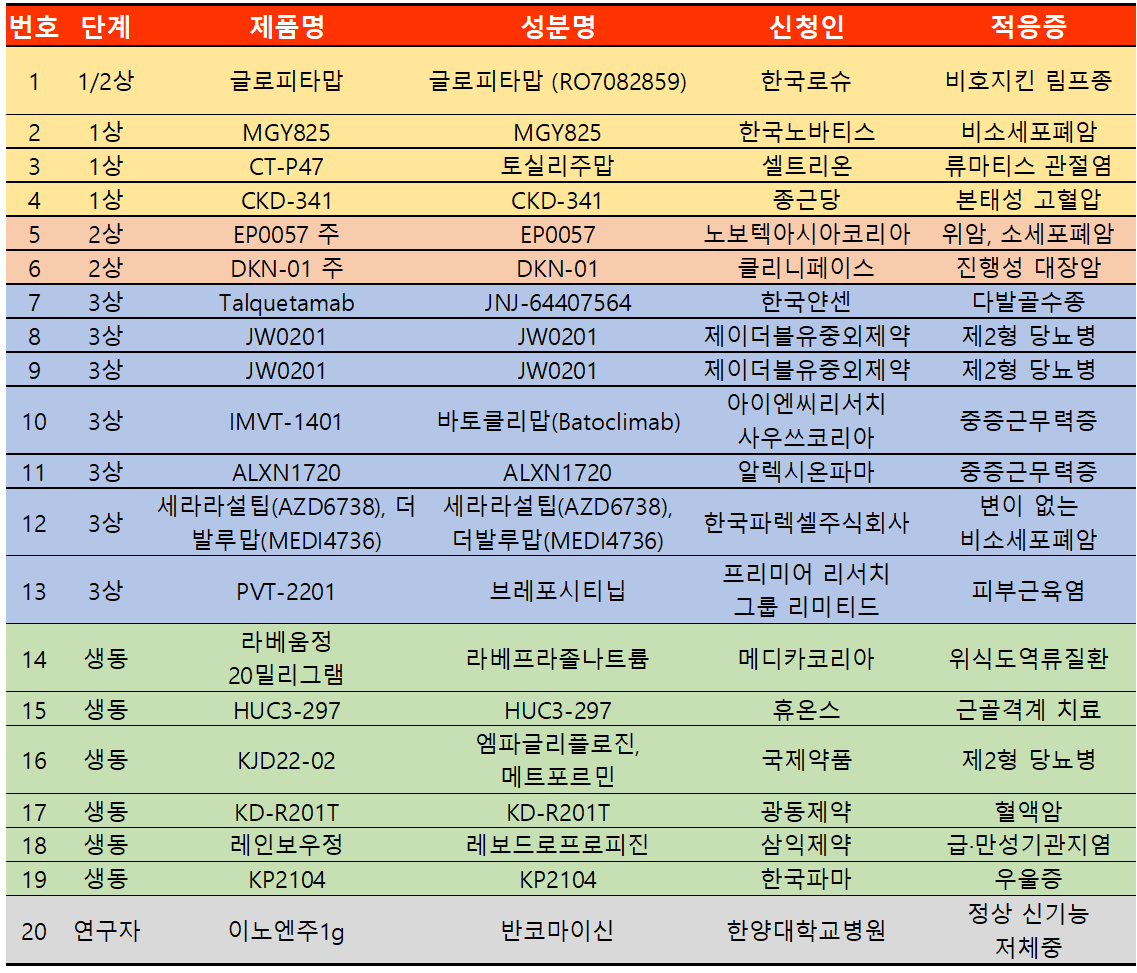
지난 주 임상시험계획은 총 20건이 승인됐다. 임상1상 4건, 2상 2건, 3상 7건, 생동 6건, 연구자 1건 등이다.
한올바이오파마의 미국 파트너사 이뮤노반트(Immunovant)가 개발 중인 차세대 자가면역질환 치료제 '바토클리맙(IMVT-1402)'이 중국과 일본에 이어 국내에서도 중증근무력증에 대해 임상 3상 승인을 받았다.
이번 승인은 전신 중증근무력증(gMG)이 있는 성인 시험대상자들에서 유도 및 유지 요법으로 바토클리맙의 유효성과 안전성을 평가하기 위한 제3상 시험으로 다국가로 전체 시험대상자수는 210명이며 국내에서는 7명이 참여할 예정이다.
캐나다, 미국, 호주, 유럽 등 총 18개국에서 바토클리맙(680mg, 340mg)과 위약을 12주간 투여해 중증근무력증 환자의 빠른 증상 개선을 유도한 후 바토클리맙 저용량 340mg을 12주 투약하며 치료 유지 효과를 측정할 계획이다.
바토클리맙은 자가면역질환을 유발하는 병원성 면역글로불린G(IgG)를 감소시키면서 질환을 치료하는 기전을 가진다.
중증근무력증의 환자에게서는 체내병원성 항체를 감소시켜 질환의 원인인 AQP 자가항체를 효과적으로 제거해 질환을 개선할 수 있는 신약으로 기대되고 있다. 또한 투약이 편리한 피하주사 제품인 점도 장점으로 꼽히고 있다.
한편 바토클리맙은 중국에서는 중증근무력증 임상3상의 첫 환자 투약이 시작됐고 일본에서도 임상 진행에 속도를 내고 있는 상황이다.

