일반품목 평균 120→51일, 코19백신 60→29일 소요
23개 신속심사 지정 품목 중 현재 17개 품목 허가 완료

식품의약품안전처가 2020년 신속심사 제도를 시행한 이래로, 대상 품목 심사 기간이 일반심사기간 대비 평균 50% 이상 단축된 것으로 나타났다.
식약처가 13일 발간한 '의약품 신속심사 보고서'를 살펴보면, 일반적으로 120일(바이오의약품 115일)이 소요되는 의약품 심사 기간(GMP 포함)은 신속심사가 진행될 경우 평균 51일로 단축된 것으로 나타났다. 코로나19백신의 경우 일반적으로 심사기간이 60일이지만, 평균 29일까지 심사기간이 단축됐다.
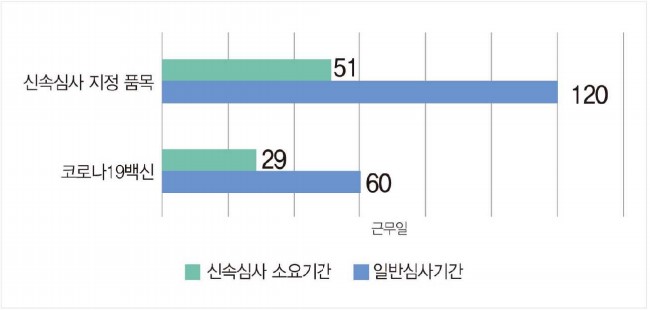
식약처는 75% 이내 기간 단축을 목표로 시행했지만, 실제 허가 기간은 평균 50% 수준인 것으로 나타났다.
식약처는 감염병의 대유행 예방·치료, 기존 치료법이 없는 생명을 위협하거나 중대한 질환 치료제 등의 의료제품 신속심사에 따른 빠른 제품화를 통해 공중보건 및 국민의 삶의 질 향상에 기여하고, 환자의 치료기회를 확대하기위해 '신속심사' 제도를 도입했다.
한국아스트라제네카의 신경섬유종 치료제 '셀루메티닙'과 SGLT-2 저해제 계열 당뇨병 신약인 대웅제약의 'DWP16001(이나글리플로진)'을 시작으로, 2020년 4품목, 2021년 11품목, 2022년 7월까지 8품목 등 총 23개 품목이 신속심사 지정됐다.
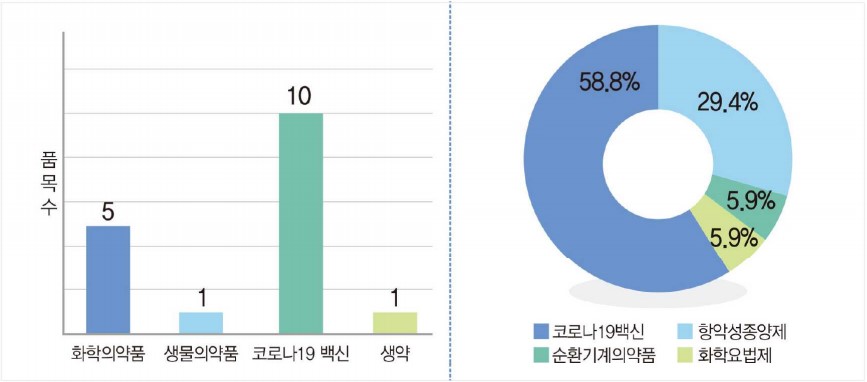
현재까지 신속심사 지정 후 허가 완료된 품목은 화학의약품 5품목, 생물의약품 1품목, 코로나19백신 10품목, 생약 1품목으로 총 17개 품목이었다. 약효군 별로는 코로나 19백신 10품목(58.5%), 항악성종양제 5품목(58.5%), 순환기계의약품와 화학요법제가 각 1품목(5.9%) 등으로 분류됐다.
수입 품목이 국내 개발·제조 품목에 비해 압도적인 비중을 차지했는데, 이 보고서는 "미국 및 유럽에서 허가를 받은 경우 신속하게 치료를 받고자 하는 우리나라 환자들의 미충족 의약품에 대한 수요가 반영된 결과로 예측된다"고 분석했다.
신속심사를 위해서는 신속심사 대상으로 먼저 지정돼야 한다. 지정 검토까지 30일이 소요되며, 식품의약품안전평가원 신속심사과에서 주관한다. 지정신청에는 구성성분, 작용기전, 제조방법, 해당 질환에서 임상적 의미가 있는 유효성을 확인할 수 있는 예비 임상시험 자료, 목표적응증 등이 필요하다.
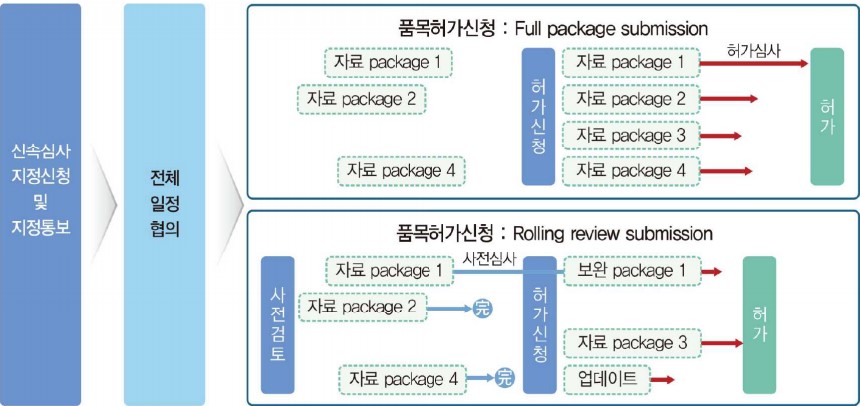
신속심사로 지정된 신청사는 식약처 심사자와 허가심사 일정 사전계획 등 전반적인 심사 일정을 공유하고, 품목설명회·보완사항 설명회 등을 개최해 소통을 이어간다. 또한, 사전 검토를 통해 준비된 자료부터 심사하는 '수시 동반 심사(Rolling review)'로 심사기간을 단축할 수 있다. 아스트라제네카·얀센·화이자 등 코로나19 백신들이 품목허가 신청 전 사전검토를 통해 준비된 자료부터 심사를 진행한 케이스다.
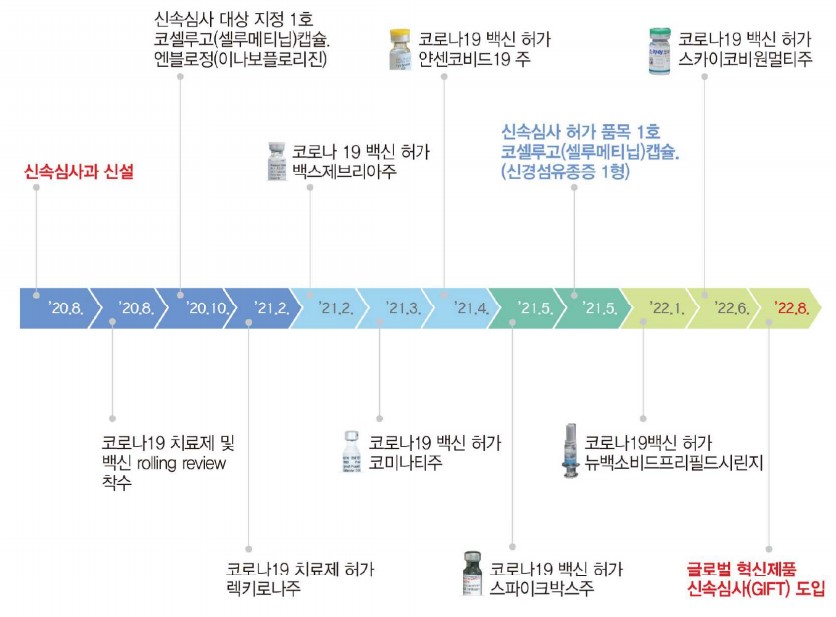
한편, 식약처는 최근 식의약 규제혁신 100대 과제의 일환으로 신속심사를 활성화하고 혁신제품에 대한 신속한 사용화 지원을 강화하기 위해 '글로벌 혁신제품 신속심사(GIFT, Global Innovative Products on Fast Track)'를 도입할 것이라고 밝힌 바 있다. 이번 '의약품 신속심사 보고서' 발간은 GIFT 본격화의 일환이라는 것이다.
GIFT 세부 지원 내역은 △개발(임상) 초기부터 신속심사 대상을 지정 △안전에 직접 관련 없는 일부 자료는 시판 후 제출할 수 있는 근거 규정 활용 △ICH 가이드라인 등 글로벌 심사기준은 해외와 시차 없이 적용하여 해외 규제기관과의 충돌 방지하고, 국내 혁신제품의 허가·심사에 국제조화 기준을 동시에 적용해 빠른 해외 진출 지원 △혁신성(안전성·유효성 개선) 뛰어난 제품은 임상결과 등 제공해 국내 의약품 개발 독려 등으로 소개됐다.