이재우 개발본부장 "FDA 자료 수준 높아지고 있어"
"허가 필요 수준에 맞출 수 있는 Justification·Rationale 능력 필요"

FDA 자료제출 요건이 높아짐에 따라, 미국 진출을 시도하는 국내 제약사의 예산과 시간 부담을 경감하기위해 제출자료를 허가 필요 수준에 맞출 수 있는 Justification(정당화) 능력이 강조되고 있다.
이재우 녹십자 개발본부장은 6일 성균관대학교 바이오헬스 규제과학과 제2회 성균 규제과학 포럼에서 미국 시장에 혈액제제와 바이오시밀러를 진출시킨 경험을 바탕으로 신약 개발을 할때 고려해야 할 요소들을 발표했다.
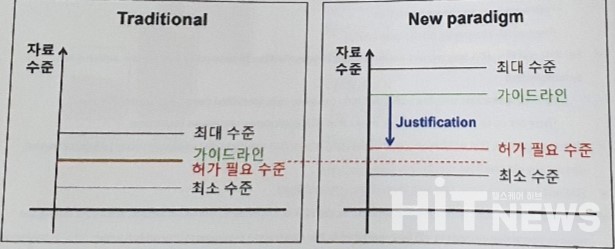
이 본부장은 "최근 과학 수준이 발전하면서 제조사가 FDA 가이드라인에 의해 요구 받는 자료 수준이 점점 높아지고 있다"며 "한정된 예산과 시간을 보유한 제약사는 그 요구사항을 허가에 필요한 수준으로 Justification과 Rationale(근거화) 할 수 있어야 한다"고 설명했다.
가이드라인이 허가에 필요한 수준 이상으로 설정돼 있으니 그 갭을 적절히 조절할 수 있는 회사가 예산과 시간을 절약할 수 있다는 것이다.
이 본부장은 "의약품 허가를 위해선 체계적인 규제 플랫폼이 필요하다"며 "허가문서인 CTD의 섹션별 필요사항을 정리함에 있어, 개발 전문가가 참여해 개발단계별로 분류하고 공정과 관련된 PD(Process Development, 공정개발), PC(Process Characterization, 공정 정의), PV(PPQ, Process Validation, 공정 검증) 별 수행해야 할 업무를 정리해야 한다"고 밝혔다.
제약사는 이 플랫폼을 구성하는 데 글로벌사와 파트너십, CRO 컨설팅, 전문인력 채용 등의 전략을 세울 수 있다.
허가 단계에서 필요한 자료를 최소화하기 위해 논리와 전략을 세우는 것도 중요하다. 이 본부장은 "물질 특성, 생산 방법, 제형, 허가 시점에 따라 필요 수준이 달라지므로, 각 상황에 맞는 과학적 근거(Scientific Rationale)를 수립해야 한다"며 "이 부분은 제품, 공정에 대한 이해를 바탕으로 실무를 통해 향상되기 때문에 사람에게 의존적"이라고 밝혔다.
사전 미팅은 '예상되는 필요 수준보다 낮은 수준의 자료를 준비하기 위한 핵심적인 전략'이라고 표현했다. 과거 임상 위주의 미팅이 대부분이었으나, 최근 CMC(제조 및 품질 관리)까지 확대되고 있다고 설명했다.
그는 "임상은 글로벌 CRO의 도움을 받아 해결할 수 있지만, CMC는 제조사가 직접해야 하는 영역"이라며 "사전 미팅 과정에서 Comparability(비교가능성), Stability(안전성), Process Validation(공정 검증) 등을 최대한 질문해 준비해야 하는 자료의 수준을 낮춰야 한다"고 밝혔다.
PQS(Pharmaceutical Quality System, 의약품 품질 관리) 또한 미국 진출 시 고려돼야 한다. PQS는 원료 구매에서 판매관리까지 제품 수명관리의 전 단계를 감독(Direct), 관리(Control) 하는 경영 시스템을 의미한다.
구성 요소는 △시정 및 예방조치(CAPA) △변경 관리 시스템 △변경 검토 △지식 관리 △품질 위험 관리 등이다.
이 본부장은 "최근 GMP(우수의약품 제조 및 품질관리기준)의 범위가 PQS로 바뀌고 있다"며 "허가가 가능한 지 아닌지 만을 고려하던 고전적 GMP 개념과 달리 이제는 허가 시점에서 품질 수준이 부족할 수밖에 없다고 판단하고, 개발이 진행됨에 따라 품질 관리와 위해도 관리 수준이 우상향 그래프를 그리고 있는 지를 평가한다"고 설명했다.
뿐만 아니라 SOP, 실험 보고서, 배치 기록 등을 제출할 때 특히 신경 써 번역해야 한다고도 강조 했다. 그는 "일반적으로 품목허가 시 제출되는 자료는 어마어마해 규제기관 리뷰어도 방대한 자료를 읽기 싫은 건 마찬가지일 것"이라면서 "재밌는 무협지가 있다면 아무리 두껍더라도 손에서 내려놓기가 싫은 것처럼 개발 전문가는 리뷰어를 배려해 좋은 스토리텔러가 돼야한다"고 설명했다.

