Kim's Weekly 2월 3주차 의약품 품목허가·임상승인 현황
만성 C형 간염, 비소세포폐암 등 2건 신약 허가
한국로슈 치매치료제 임상시험 3상 승인

길리어드사이언스코리아의 만성 C형 간염바이러스 치료제 '엡클루사정(소포스부비르, 벨파타스비르)'과 암젠코리아의 비소세포폐암 치료제 '루마크라스정 120밀리그램(소토라십)'이 식품의약품안전처 신약 품목허가를 획득했다.
한국로슈는 치매신약 '간테네루맙주' 임상시험 3상을 승인받았다.
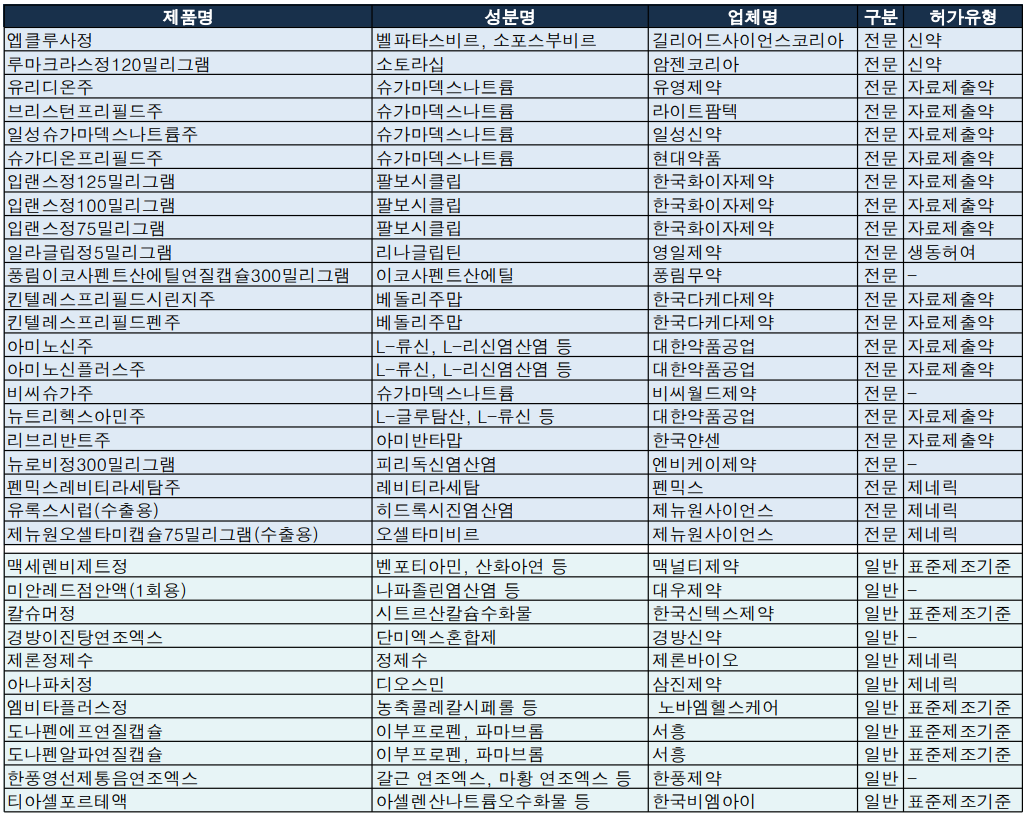
지난주(2022.02.14~2022.02.20) 식약처는 의약품 33품목(전문: 22개, 일반: 11개), 임상시험 39건(1상: 34개, 2상: 1개, 3상: 2개, 연구자: 2개)을 각각 승인했다.
C형 간염, 비소세포폐암 등 2건 신약 허가
길리어드사이언스코리아 엡클루사정은 소포스부비르, 펠파타스비르 성분의 1~6형 만성 C형 간염 바이러스(HCV) 치료제로 허가사항에 따르면 대상환자는 성인 및 만 12세 이상, 체중 30kg 이상의 소아환자다.
단독요법 혹은 리바비린과 병용해 사용되는데, 간경변이 없거나 대상성 간경변(Child-Pugh A)이 있는 이전 치료경험이 없는 환자의 경우 12주간 단독요법이, 비대상 간경변(Child-Pugh B 또는 C)이 있는 치료경험이 없는 환자의 경우 12주간 리바비린과 병용요법이 권장된다.
암젠코리아 루마크라스정120밀리그램은 비소세포폐암치료제로 치료 경험이 있는 KRAS G12C 변이 국소 진행성 또는 전이성 비소세포폐암 성인 환자를 대상으로 한다.
관련기사: 암젠 KRAS 폐암 표적치료제 '루마크라스' 허가
회사에 따르면 KRAS는 비소세포폐암을 포함한 여러 암종에서 발견되는 주요 종양 유전자 중 하나로 비소세포폐암에서는 전체 유전자 변이의 약 25%를 차지할 만큼 폐암 발생과 밀접하며 아시아 환자에서는 EGFR 다음으로 흔하게 발생하는 유전자 변이다.
루마크라스정은 경구투여제로 허가사항에 따르면 1일 1회 960mg(8정)용량으로 수용할 수 없는 독성이 발생할 때까지 경구 투여한다.
한국로슈 치매치료제 임상시험 3상 승인
한국로슈의 알츠하이머병 치료제 '간테네루맙주(RO4909832)'가 임상시험 3상을 승인받았다. 글로벌 1200명을 대상으로 진행되며 국내에서는 알츠하이머병 발생 위험이 있거나 초기 알츠하이머병 환자 36명이 참여할 계획이다.
건국대학교병원, 길병원, 동아대학교병원, 분당서울대병원, 삼성서울병원, 인하대학교부속병원, 서울아산병원, 전남대병원, 서울성모병원, 한양대병원이 실시할 예정이다.
간테네루맙주는 지난해 FDA가 혁신치료제로 지정된 바 있다.
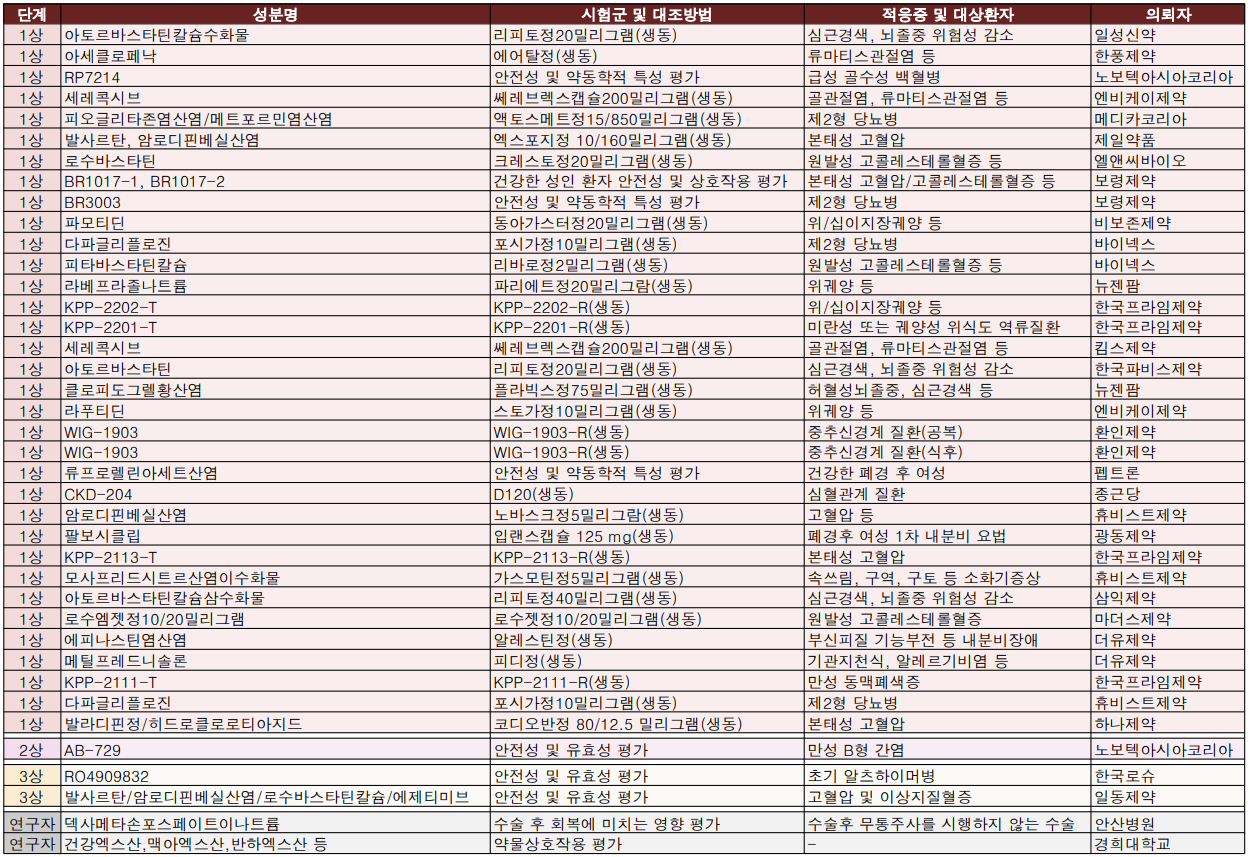
이밖에 일동제약은 고혈압 및 고지혈증 동반질환 4제 복합제(발사르탄/암로디핀/로수바스타틴/에제미티브) 임상시험 3상을 승인받았다.
지씨씨엘, 강원대학교병원, 경희대학교병원, 고려대학교 부속 구로병원·안산병원, 길 병원, 노원을지대병원, 부산대학교 병원, 분당서울대병원, 서울대병원, 강동성심병원, 세브란스병원, 서울아산병원, 전남대병원, 분당차병원, 고대의과대 부속병원이 참여하며 국내환자 135명을 대상으로 진행될 예정이다.

