Kim's Weekly 2월 2주차 의약품 품목허가·임상승인 현황
브리디온주 제네릭 무더기 승인
애브비, 이중 특이성 항체 국내임상 승인

2022년 4월 12일 특허가 만료되는 MSD의 근이완 길항제 브리디온주(슈가마덱스나트륨) 품목허가가 지난주 본격 시작됐다.
지난주(2022. 02. 07~2022. 02. 13) 식품의약품안전처는 슈가마덱스나트륨 품목 12개를 포함해 의약품 42품목(전문약: 30개, 일반약: 12개), 임상시험 22건(1상: 11건, 2상: 3건, 3상: 6건, 연구자: 2건)을 각각 승인했다.
브리디온주 제네릭 무더기 승인
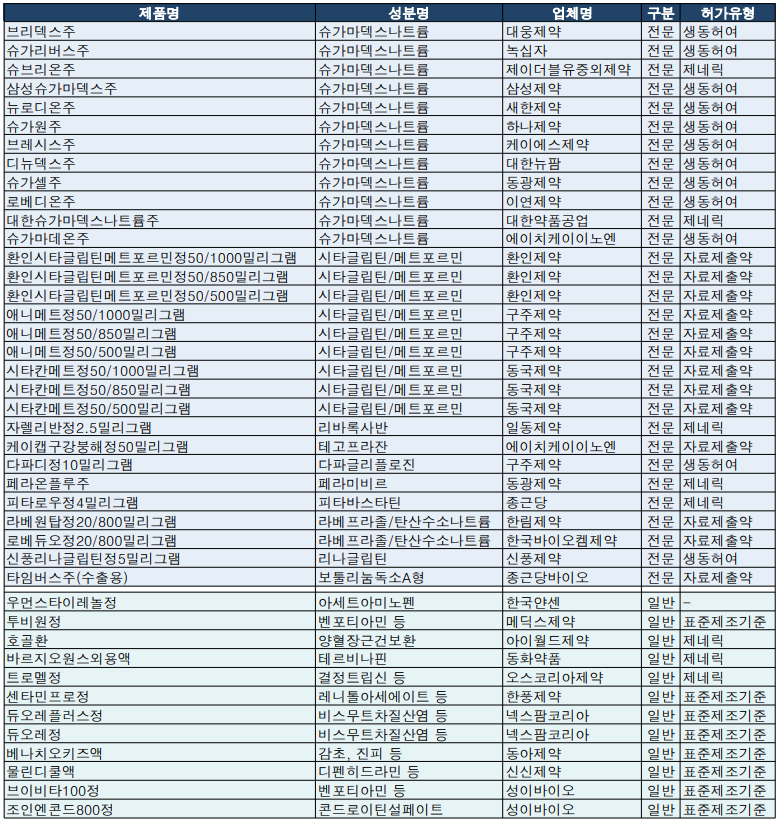
대웅제약, 녹십자, JW중외제약, 삼성제약, 새한제약, 하나제약, 케이에스제약, 대한뉴팜, 동광제약, 이연제약, 대한약품공업, HK이노엔 등 12개 업체는 지난주 슈가마덱스나트륨 품목 허가를 획득했다.
이미 품목허가를 획득한 한림제약, 한국 산도스, 한국 비엠아이, 휴온스, 보령제약과 제일약품까지 19개 업체가 품목허가를 획득했고, 4월 이후 시장 경쟁이 예상된다.
브리디온주의 특허 '6-메르캅토시클로덱스트린 유도체: 약물 유도 신경근차단용 반전제'가 4월 12일 만료되기 때문이다.
MSD의 제2형 당뇨병 치료제 자누멘트정 제네릭인 시타글립틴과 메트포르민 복합제 허가 역시 이어졌다. 환인제약과 구주제약, 동국제약은 환인시타글립틴메트포르민정, 애니메트정, 시타칸메트정 허가를 각각 획득했다.
애브비, 차세대 이중 특이성 항체 국내임상 승인
2020년 6월 애브비와 젠맙 계약을 통해 공동개발한 차세대 이중 특이성 항체 후보물질 엔코리타맙(Epcoritamab)이 임상시험 1상을 승인받았다.
임상시험 제목은 '공격적인 재발성/불응성 성숙 B세포 신생물을 앓고 있는 소아 환자를 대상으로 한 Epcoritamab 단일군, 라벨 공개, 제1b상 임상시험'으로 글로벌 15명(국내 2명)을 대상으로 진행된다. 삼성서울병원과 서울대학교병원이 실시기관으로 지정됐다.
한국다이이찌산쿄는 키트루다(펨프롤리주맙) 단독요법과 개발 중인 후보물질(Dato-DXd)과 키트루다 병용요법을 비교하는 임상시험 3상을 승인받았다.
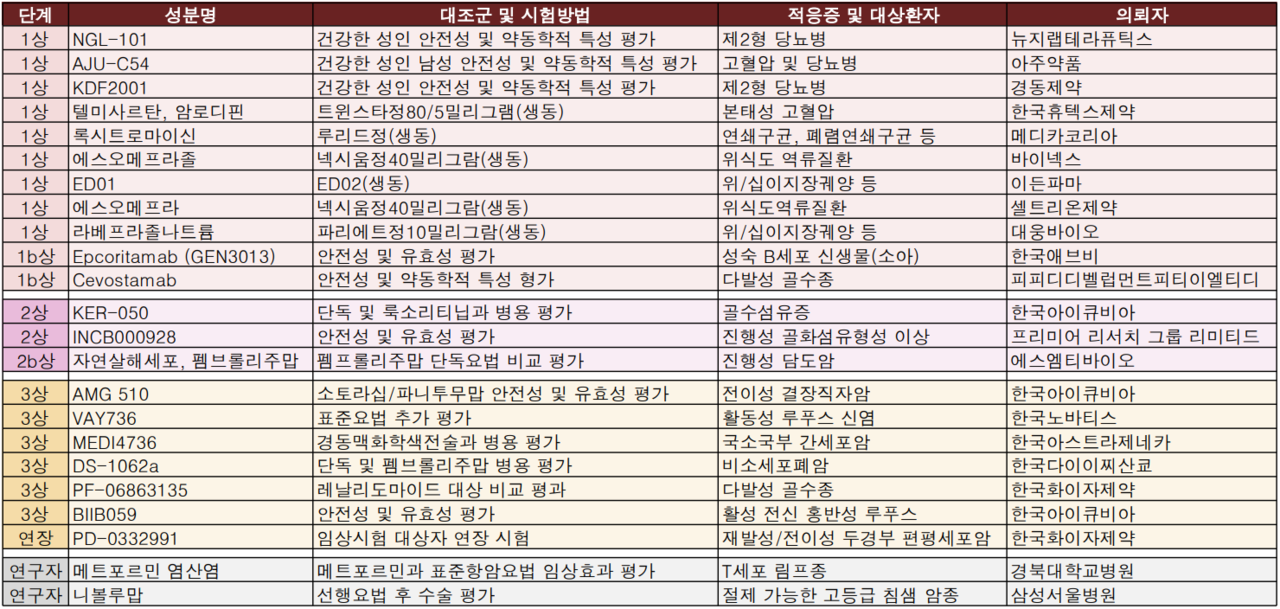
대상은 치료 경험이 없고 조치 가능한 유전체 변이가 없는 진행성 또는 전이성 PD-L1 고발현(TPS≥50%) 비소세포폐암 환자 740명(국내 36명)으로, 국립암센터, 분당서울대병원, 삼성서울병원, 서울아산병원, 충북대병원 등이 진행한다.

